|
|
A víz, bár egyike a legegyszerűbb kémiai
összetételű anyagoknak, ugyancsak egyike a legkomplikáltabb
fiziko-kémiai viselkedést felmutatóknak is. Különleges tulajdonságai
teszik lehetővé az életnek azt a formáját, amit ismerünk,
olyannyira, hogy a biológiai molekulák (fehérjék, lipidek,
nukleinsavak stb.) szerkezete és funkciója csak a körülöttük levő
vízzel együtt értelmezhető. Erről az „együttes létről” azonban
sokszor elfeledkeznek még a biológia területén kutatók is, és úgy
értelmezik a jelenségeket, mintha azok csak az adott biológiai
molekula viselkedésének következményei lennének, nem pedig egy
biomolekula–víz–(+más biomolekulák) komplexnek.
A víz szerkezetének például a fehérjék viselkedésére való direkt
hatásáról már 1888 óta vannak ismereteink, amikor is Franz
Hofmeister úgy tudott sorba rendezni ionokat (elsősorban az anionok
– F- ≈ SO42- > HPO42- >
CH3COO- > Cl- > NO3-
> Br- > ClO3- > I- > ClO4-
> SCN- – bizonyultak érdekesnek), hogy azok a sorban
balról jobbra haladva a kicsapatástól (kozmotróp hatás) a fokozott
oldódásig (kaotróp hatás) tudták befolyásolni a fehérjék
viselkedését. Kiderült, hogy a látható hatáshoz szükséges magas
koncentrációjuk (>100 mM) nem általában változtatja meg a víz
szerkezetét, hanem az a döntő, hogyan befolyásolják a fehérjékkel
érintkező/azokhoz igen közel levő vízmolekulák rendezettségét,
illetve kölcsönhatási lehetőségeit.
Mivel ilyen koncentrációjú sók az élőlényekben
nincsenek, de maga az „élő anyag” olyan sűrű, hogy általában csak
néhányszor tízmolekulányi vízréteg választja el a sejt belsejében a
biomolekulákat, kíváncsiak voltunk, vajon maguk a biomolekulák
képesek-e a velük érintkező víz szerkezetének befolyásolására, és
ezen keresztül saját szerkezetük, illetve a pár molekulányi vízréteg
másik felén levő más biomolekulák körülményeinek megváltoztatására.
A méréseket infravörös spektroszkópiával végeztük,
annak olyan módjával, amikor egy nagy törésmutatójú kristály
(ATR-kristály) belsejében haladó fény a kristály felszínénél teljes
visszaverődést szenved, és abszorbeálódik a felszínen kívül levő
molekulákban. Így fel tudjuk venni azok infravörös spektrumát
(attennuated total reflection [ATR] spectroscopy). A vizsgálatokhoz
a 95% H2O + 5% D2O keverékéből előálló kb.
10%-nyi HDO molekula 2500 cm-1 közelében levő O-D
rezgését használtuk, mert az nem fed át semmilyen más víz-, vagy
biomolekula-eredetű rezgéssel.
Először azt néztük meg, hogy meg tudjuk-e látni a
várhatóan legnagyobb effektust, a Hofmeister-sók által okozott
szerkezetváltozást a víz-spektrumokban. Mint az 1. ábrán
látható, a tiszta HDO O-D rezgéséhez képest, a (0,9 M sóoldat
[szintén HDO-ban] mínusz tiszta HDO) spektrumokban oldalsávok
jelennek meg; a kaotróp só esetében magasabb, a kozmotróp esetében
pedig alacsonyabb hullámszámoknál (cm-1). A
Hofmeister-hatás szempontjából semleges NaCl kis intenzitású,
szimmetrikus oldalsávokat adott a tiszta HDO O-D sávjának két
oldalán.
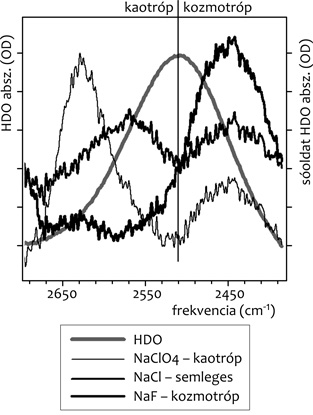
1. ábra • H2O és D2O
keverékéből (95:5) előállított kb. 10%-nyi HOD-molekula O-D nyújtási
rezgésének Fourier-transzformációs infravörös spektruma, illetve az
ilyen vízkeverékben feloldott sók (0,9 M) mínusz tiszta
HDO-spektrumok.
A víz szerkezete szempontjából a kozmotróp hatás azt jelenti, hogy a
vízmolekulák között a tiszta vízhez képest nagyobb számban alakulnak
ki (erős) hidrogénhidak, amikben mind az O, mind a D atom részt
vesz. Az O/D atomra irányuló külső vonzás következtében az O-D kötés
távolsága valamelyest nő, ezért a köztük levő vonzóerő csökken,
aminek következtében kisebb energia kell az O-D kötés menti rezgés
gerjesztéséhez. Ez látszik meg az alacsonyabb hullámszámban (NaF
spektrum az 1. ábrán). Kaotróp hatás esetén a vízmolekulák
közti hidrogénhidak száma csökken, ezért a fenti logika szerint
esetükben az O-D kötés átlagos távolsága csökken, a megrezgetéséhez
szükséges energia pedig nő (lásd a magasabb hullámszámot a NaClO4
esetében az 1. ábrán). Az ilyen hatások révén átalakult
szerkezetű vizet a továbbiakban kozmotróp, illetve kaotróp víz néven
említjük.
Ezután azt vizsgáltuk meg, vajon a fehérjék a
felszínükön levő víz infravörös spektrumában képesek-e hasonló
oldalsávokat létrehozni, amelyek ott szintén a szabadtól eltérő
szerkezetű víz jelenlétére utalnának. Azt, hogy tényleg csak a
molekulák felszínén levő vízmolekulákat lássuk, úgy értük el, hogy
fokozatosan beszárítottuk az ATR-kristály felszínére kis cseppekben
(kb. 10 csepp, összesen 20 µl) felvitt mintákat. Az oldalsávok
megjelenését a száradás során sorozatban felvett infravörös
spektrumokból egy, tisztán algebrai módszerrel (ami tehát nem kívánt
meg semmilyen előzetes feltevést), határoztuk meg (szinguláris
értékekre való lebontás [SVD]).
|
|
|
Egyik példaként a β-kazeint vizsgáltuk. A
2. ábrán látható, hogy az U
első komponense (u1) jól egyezik a tiszta HDO O-D rezgés sávjának
alakjával, amint annak lennie is kell, hiszen ez a komponens az
„átlagos” – esetünkben a szabad – víz spektrumát jelenti. A második
komponens (u2) azonban mind a kaotróp, mind a kozmotróp oldalon
mutat sávokat, jó egyezésben a β-kazein amfifil természetével. A
β-kazein tartalmaz egy nagy hidrofób régiót (kaotróp sáv), amely
révén más kazeinmolekulákkal aggregálódik a Ca++-szállító
kazeinmicellák kialakulásának első lépésében, illetve egy erősen
poláros, foszfoszeril oldalláncokat tartalmazó régiót, amelyhez a
Ca-foszfát tud kötődni (kozmotróp sáv).
Más fehérjékre is megmutatható, hogy a fehérje
felszíne olyan módon befolyásolja az őt burkoló víz rendezettségét,
ami megfelel a fehérje biológiai funkciójának. Például, annak
ellenére, hogy térszerkezetük hasonló, a mioglobin elsősorban
„kaotróp vizet”, a hemoglobin „kozmotróp vizet” alakít ki maga
körül. Ez megfelel annak, hogy a mioglobinnak elsősorban más
fehérjékkel kell kölcsönhatnia, és ehhez segítség, hogy a felszínén
levő, „önmagát szerető” kaotróp víz ki tud menekülni a kölcsönható
fehérjék közül. Ezzel szemben a hemoglobinnak elsősorban az
oxigént/szén-dioxidot kell nagy, akár makroszkopikus távolságban
levő rendeltetési helyére juttatnia, ebben kerülendőek a más
fehérjékkel való kölcsönhatások. Ehhez a neutralitáshoz a
hemoglobint körülvevő „fehérjeszerető” rendezett kozmotróp víz, a
fehérje–fehérje kontaktusok valamelyes „leárnyékolásával”,
segítséget tud nyújtani. (Ezeket az adatokat terjedelmi okok miatt
nem mutatjuk.)
Az élőlényekben a membránok rendkívül fontos
szerepet játszanak mind az egyes térrészek elválasztásában, mind a
térrészek közti anyagtranszport, illetve jelátadás lehetővé
tételében/gátlásában. Mivel az elválasztott térrészek mindegyike
vizes fázisú, megnéztük, meg tudjuk-e mutatni, megváltozik-e a víz
szerkezete egy lipid modell membrán (dioleoil-foszfatidilkolin
[DOPC]:koleszterol [Kol], 10:1), illetve egy biológiai membrán
(tilakoid) felszínén (3. ábra). Jól látszik, hogy a
modellmembrán felszínén a víz szerkezete kozmotróp irányba tolódik
el (lásd a negatív sávot a kaotróp oldalon és a folyamatos
növekedést a kozmotróp oldalon. Ezzel szemben a valódi biológiai
membránban jelen van mind a kozmotróp víz (2450-60 cm-1
körül), mind a kaotróp víz (2640-50 cm-1 körül). A
kaotróp víz minden valószínűség szerint a jelenlevő membránfehérjék
következménye, amelyek sok (más fehérjékkel való kölcsönhatásra,
receptor feladatokra stb. szolgáló), a vizes fázisba benyomuló
oldallánccal rendelkeznek.
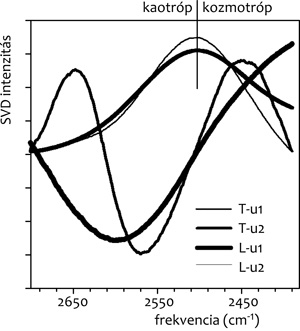
3. ábra •Dioleoil-foszfatidilkolin (DOPC) és
koleszterol (Kol) 10:1 arányú keverékéből készített liposzómák,
illetve egy Cianobaktérium tilakoid membrán szuszpenzió beszárítása
során a környezetükben levő víz szerkezetváltozásának nyomon
követése SVD-analízissel (csak a komponens spektrumokat mutatjuk,
részletek az előző ábrán). A HDO-molekulák O-D rezgésének első (u1),
második (u2) komponens spektruma tilakoid (T), illetve DOPC/
Kol-membránok (L) környezetében.
Összefoglalva: sikerült megmutatnunk, hogy a
biológiai molekulák megváltoztatják a velük kölcsönhatásban levő
vízmolekulák egymás közti kapcsolódásának rendjét. Képesek
felszínükön kaotróp, illetve kozmotróp vízből álló „párna”
kialakítására. A kaotróp vízben a vízmolekulák közti kölcsönhatások
átlagban erősebbek, mint a vízmolekulák és az adott biológiai
molekula közti kölcsönhatások; a kozmotróp vízben a vízmolekulák és
a biológiai molekulák közti kölcsönhatás – erős hidrogénhidak révén
– erősebb, mint a vízmolekulák közti átlagos kölcsönhatás. Egy ilyen
vízpárnának nagy jelentősége lehet például a stresszfehérjék
esetében, ahol egy-egy fehérje sok különféle folyamatban tud
hatásosan részt venni; olyanokban, amelyekben nem lehet
feltételezni, hogy a fehérjékre egyébként jellemző, atomi szintű
specificitáson alapuljon a hatékonyság. Ha például egy membrán
stabilizálásáról lenne szó, egy, a stresszfehérjét körülvevő,
rendezett vizet tartalmazó kozmotróp vízpárna a stresszfehérje és a
membrán közé „szorulva” a membránnal kialakított hidrogénhidak révén
megvédheti a membránt a túlzott fellazulástól. A rosszul
feltekeredett fehérjék térszerkezetét helyreállítani képes
„dajkafehérjék” működése is alapulhat olyan mechanizmuson, hogy
belsejükben erősen kaotróp vizet kialakítva az áttekerendő fehérje
döntően csak saját térszerkezeti információira, energetikai
viszonyaira kénytelen támaszkodni, amíg meg nem találja
energiaminimumát. Ebben a dajkafehérjével való kölcsönhatások a
köztük lévő kaotróp vízpárna miatt nem fogják zavarni.
Egy ilyen általános, „vízalapú”, elsődleges
kölcsönhatási rendező elv egyelőre csak egy hipotézis, melyet az
eddigi eredmények nem bizonyítanak be, de lehetséges voltát, és így
a további ilyen irányú kutatásokat bátorítják.
Kulcsszavak: HDO, Hofmeister-effekt, fehérjeszerkezet,
fehérjestabilitás, vízszerkezet
|
|