|
DNS-szakaszok és egy
szelektálható jelzőgénnel történt összeépítés után megkezdődtek a
DNS-beviteli kísérletek. 1989 végén megszülettek azok a sejtvonalak, amelyekben a bevitt DNS-ből felépült új
centromerek, illetve önálló minikromoszómák képződtek (7. ábra).
A
jelenség ismételhetőnek bizonyult, és hamarosan a minikromoszómák
méretét többszörösen meghaladó, új kromoszómát hordozó sejtvonalakat
is sikerült előállítani olyan DNS bevitelével is, amely nem
tartalmazott feltételezett centromerikus DNS-t (8. ábra).
Nyilvánvalóvá vált, hogy a centromer- és kromoszómaképződés nem a
bevitt DNS specifikus bázissorrendjétől függ.
Ezt az időszakot a töretlen lelkesedés és a pénzhiány jellemezte. A
napi túlélésért folyó küzdelemben és a minikromoszóma
megszületésében döntő szerepe volt az SZBK akkori főigazgatójának,
Keszthelyi Lajosnak. Fizikus-biofizikusként a
mesterségeskromoszóma-program kezdetétől állandó érdeklődéssel
követte a munkát, és az ínség időszakában személyes közbenjárására –
pályázaton kívül kapott – mintegy kétmillió forint OMFB-„segély”
biztosította a túlélést. Az első eredmények közlése (két PNAS-cikk)
jelentős nemzetközi érdeklődést váltott ki. A közlést és a további
munkák pénzügyi hátterét a szerencse és a személyes kapcsolatok
határozták meg. 1989-ben két amerikai professzor (egyikük Szalay
Aladár, az SZBK Növényélettani Intézetéből a 70-es években
„külföldre szakadt” hazánkfia), hasznosítható alapkutatási
eredményekre „vadászva” az SZBK-ban úgy vélte, hogy ez a
minikromoszóma egyike a lehetséges értékesíthető eredményeknek.
Szalay Aladár kapcsolatai révén a kanadai Alberta tartományi kormány
kutatástámogatása, majd egy amerikai óriásvállalat biztosította a
kutatások részbeni finanszírozását, a kutatási eredmények
szabadalmaztatási költségeit az esetleges, jövőbeni szabadalmak
hasznosítási jogáért cserébe. Itthon, 1991-ben, az akkori
földművelésügyi miniszterrel mint társpályázóval elnyert hároméves
OMFB-pályázat keretében mintegy húszmillió forint biztosította a
további munka pénzügyi hátterét. Így az amerikai és az OMFB kutatási
támogatás révén az elkövetkező négy-öt év anyagi biztonsága
lehetővé
tette az aprólékos kísérleti munkát, amelynek eredményeként –
elsősorban egy nagyméretű, egérsejtekben előállított új kromoszóma
révén – kiderült, hogy a kromoszómaképződés egy, a sejt
meghatározott kromoszómáinak centromerközeli szakaszába épült
„idegen” DNS által előidézett megsokszorozódás eredménye (9. ábra).
Az újonnan képződő kromoszómák tehát az élő sejtben történt
beavatkozás eredményei. A stabil fennmaradásukhoz és működésükhöz
szükséges elemeket a „természetes” kromoszómák meghatározott
szakaszainak megsokszorozódása révén „szerzik” meg, DNS-összetételük
kevésbé komplex, elsősorban ismétlődő, azonos bázissorrendű
szakaszokból épülnek fel, így jelentősen eltérnek a „természetes”
kromoszómáktól. Ez a tény, és az, hogy az újonnan képződött
„mesterséges” kromoszómák genetikai tartalma – a tandem ismétlődő
riboszomális RNS-génektől eltekintve – kizárólag a kívülről bevitt
génekre korlátozódik, indokolja a „mesterséges” jelzőt.
A centromerközeli szakaszok döntően heterokromatinból (erősen
„becsomagolt”, géneket nem hordozó, ismétlődő, ún. szatellit
DNS-szakaszok) épülnek fel, így az újonnan képződött kromoszómák
alapanyaga is főként szatellit DNS (10. ábra).
Ebből a tulajdonságukból adódóan a szatellit DNS-alapú mesterséges
kromoszómák (SATAC) gyakorlatilag 100%-os tisztaságban
elválaszthatók a „természetes” kromoszómáktól kettős, lézervezérlésű
áramlásos citometriával (11. ábra).
Erre az időszakra esett, hogy az amerikai támogatás (a mesterséges
kromoszómáktól független okok miatt) megszűnt, viszont a munka
folytatását célzó, nagy ívű négyéves kutatási pályázatra, a
munkatervet változatlanul hagyva, az OTKA megadta a kért kutatási
támogatás 5%-át, azaz évi 200 000 Ft-ot. A teljes pályázati összeg
éppen fedezte annak a két közleménynek a publikációs költségeit,
amelyek a szatellit DNS-alapú mesterséges kromoszómák prototípusának
leírását, illetve a kromoszómaképződés alapvető folyamatainak
tisztázását és ezáltal az ismételhető kromoszómaépítés módszerének
kidolgozását írták le.
Itt újra érdemes egy rövid kitérőt tenni, ami rávilágít az
esélyegyenlőségre és a globális tudomány geográfiai és etikai fehér
foltjaira. A fent említett két közlemény kétségkívül az első közlése
volt az emlős mesterséges kromoszómák ismételhető előállításának.
Egy évvel később az Egyesült Államokban megjelent mesterséges
kromoszóma előállítását leíró közleményt a média jelentős
csinnadrattával mint világelső felfedezést ünnepelte. Joggal, hiszen
a szerzők említést sem tettek az őket megelőző négy, Magyarországról
származó munkáról. A dolog pikantériája, hogy az amerikai szerzők, a
tudományos közleményük megjelenésével egy időben benyújtott
szabadalmukban oldalakon keresztül próbálják bizonygatni, hogy
eljárásuk különbözik a négy szegedi közleményben leírtaktól.
A pénztelenségből fakadó lét-nemlét dilemma feloldása Kanadából
érkezett. A mesterséges kromoszómák ismételt előállítását, illetve a
mesterségeskromoszóma-tisztítás eredményeit ismerve, egy kanadai
üzletember 1995 végén bejegyeztette a vancouveri székhelyű Chromos
Molecular Systems nevű biotechnológiai vállalatot, amely a szatellit
DNS-alapú mesterséges kromoszómák biotechnológiai alkalmazását, a
SATAC-technológia kifejlesztését tűzte ki célul. A Chromos 1996-ban
kizárólagos hasznosítási licencszerződést kötött a Szegedi Biológiai
Központtal, és hosszú távú kutatási szerződést írt alá az SZBK
Genetikai Intézetével. E szerződések keretében vállalta az évi
rendszeres kutatási támogatás biztosítását, a kutatási eredmények
szabadalmaztatási költségét, a technológia majdani hasznosításából
származó bevételekből – a nemzetközi normáknak megfelelő – jogdíj
fizetését. A Chromos létrehozta saját kutató-fejlesztő
laboratóriumát, és 1997-ben megkezdődött a közös kutatómunka és
technológiafejlesztés. Ennek főbb eredményei a következők voltak:
• a mesterséges kromoszómák ipari méretekben történő tisztítása,
• „hasznos” géneket hordozó mesterséges kromoszómák előállítása,
• humán szatellit-DNS-alapú mesterséges kromoszóma prototípusának
előállítása (12. ábra),
• genetikailag módosított állat előállítása tisztított mesterséges
kromoszómával (13. ábra),
• genetikailag módosított állat előállítása szövetspecifikus
génkifejeződést biztosító tisztított mesterséges kromoszómával,
• lipidekbe csomagolt tisztított mesterséges kromoszómák bevitele
célsejtekbe,
• feltölthető, mesterséges kromoszóma expressziós rendszer
létrehozása (14. ábra),
• ipari fehérje-gyógyszeralapanyagot termelő mesterséges kromoszómák
előállítása.
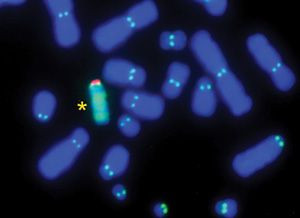
12. ábra • Emberi mesterséges kromoszóma prototípus (*) természetes
társai között DNS-hibridizáció human szatellit DNS-sel (zöld és
piros), illetve centromer immunfestés (kettős, világos pöttyök), a
kromoszómák kék színét egy DNS-specifikus fluoreszcens festék adja
2000-ben a Chromos a torontói tőzsdén nyílt részvénytársasággá vált,
ettől kezdve a vállalati stratégiát, beleértve a
kutatási-fejlesztési célokat, irányokat a befektetők rövid távú
érdekei (gyors tőkemegtérülés) határozták meg. 2004-ben a
mesterséges kromoszóma expressziós rendszer létrehozásakor az
elsődleges stratégiai irány a gyógyszeripari fehérjetermelés lett.
Ez azt is jelentette, hogy a kutatás-fejlesztés kizárólagos iránya a
gyógyszeripari fejlesztés, amelyet az elsődlegesen alapkutatást
végző Genetikai Intézet Kromoszóma Csoportja nem vállalhatott. A
kutatási szerződés (és a kutatási támogatás) megszűntével, hazai
pályázati forrásból és az utolsó, jelképes Chromos-támogatásból
2005-ben elindult egy kísérletsorozat, amely a mesterséges
kromoszóma és az őssejttechnológia ötvözésével a mesterséges
kromoszómák génterápiai alkalmazhatóságát kívánta igazolni. Ennek
szakmai hátterét a meglévő „kromoszóma csapat” tudása mellett, a
hároméves tanulmányútról hazatért és magát őssejtszakértővé kiképező
Katona Róbert biztosította. A modellkísérlet egy ma még
gyógyíthatatlan betegség (Krabbe-betegség) egérmodelljének kezelése
volt terápiás emlős mesterséges kromoszómát hordozó embrionális
őssejtekkel. A hároméves kísérletsorozat eredményei igazolták, hogy
a kombinált mesterséges kromoszóma-őssejt technológia alkalmas
eszköze lehet az ex vivo génterápiának (15. ábra).
2006 nyarán a Pfizer gyógyszeripari óriásvállalat nyilvánosságra
hozta saját összehasonlító vizsgálatainak eredményét, miszerint a
mesterséges kromoszómarendszerrel bioreaktorokban literenként 4
grammot meghaladó fehérje-gyógyszeralapanyag termelése érhető el,
amely ötszörösen meghaladta saját fehérjetermelő rendszerük
teljesítményét.
Ezek az eredmények döntő szerepet játszhattak abban, hogy a Pfizer
legnagyobb versenytársa, a GlaxoSmithKline 2007-ben
megvásárolta a mesterségeskromoszóma-technológia fehérjetermelésben
történő felhasználásának jogát a forráshiánnyal küszködő Chromostól.
A technológia transzgenikus és génterápiai felhasználásának joga a
Chromosnál maradt. A többéves közös munka és a Chromos vezetésével
meglévő jó kapcsolatoknak köszönhetően a Chromos licencszerződés
keretében teljes körű felhasználási jogot adott a Szegedi Biológiai
Központ számára a mesterségeskromoszóma-technológia magyarországi
génterápiai, gyógyító célú felhasználására. A teljes körű
felhasználás kiterjed a negyvenkilenc mesterségeskromoszóma-tárgyú
szabadalmaink hasznosítására, amelyek tulajdonosa a Szegedi
Biológiai Központ, illetve magában foglalja a Chromos saját
fejlesztéseit is.
Az első modellkísérlet sikerére alapozva, hazai és Európai Uniós
pályázatok keretében, jelenleg három mesterséges kromoszóma-őssejt
technológiára alapozott preklinikai kutatási program folyik
állatmodelleken, illetve sejtszinten: 1. Egy életmentő génterápiai
kezelés súlyos mellékhatásának (a terápiás gént hordozó vektor által
okozott leukémia) lehetséges kiküszöbölése mesterséges
kromoszómavektorral. 2. Egy mesterséges kromoszómával két vagy több
terápiás cél elérésének egyidejű megvalósíthatóságát igazoló
daganatterápiás modellkísérletek. 3. Idegrendszeri betegségek
lehetséges kezelési eljárásainak kidolgozása mesterséges
kromoszómával genetikailag módosított terápiás őssejtekkel.
Az elmúlt évek során a Genetikai Intézetben sikerült létrehozni egy
olyan preklinikai egységet, amely elvileg alkalmas bármely
génterápiai szempontból releváns betegség állatmodelljének
mesterséges kromoszóma-őssejt terápiával történő kezelésére.
A szegedi „kromoszóma csapat” szűkebb és tágabb értelemben vett
tagjaira vonatkozóan eligazítást adnak az intézeti publikációs lista
szerzői névsorai. Ám lehetetlen felsorolni mindazok nevét, akik az
elmúlt közel négy évtized során, itthon és világszerte munkával,
tanáccsal, kritikával, segítséggel vagy csak jóindulatú
érdeklődéssel járultak hozzá, hogy a szegedi kromoszómakutatás
eredményei nemzetközi szinten is tankönyvi adatokká válhattak, és az
alapkutatási eredményekből használható technológia született.
Kulcsszavak: génterápia, kromoszómastruktúra, mikroszkópia,
mesterséges kromoszóma, őssejt, sejtfúzió, szatellit DNS,
transzgenikus egér
|