|
ABC-eredetű csoportban a kezelés tizenhárom
betegnél eredményezett komplett remissziót (62%), és hat beteg halt
meg egy éven belül, míg a GCB-csoportban tizenkilenc beteg (83%)
került komplett remisszióba, és három beteg halt meg – a két csoport
túlélése szignifikánsan különbözött. A GCB-csoportban a tumoros
mikrokörnyezet szignifikánsan több CD3+ limfocitát tartalmazott, és a
CD4/CD8-arány is szignifikánsan magasabbnak bizonyult az
ABC-csoporthoz képest, és a CD3+ T-limfociták denzitása is
prognosztikusnak bizonyult. Magasabb proliferációs rátát észleltünk a
progrediáló esetekben. A komplett remissziót mutató esetekben
szignifikánsan több CD3+ T-limfocitát, illetve szignifikánsan több
CD8+ cytotoxikus T-limfocitát észleltünk.
Célkeresztben a daganatos beteg:
a molekuláris medicina lehetőségei
Az endoplazmás retikulum lumen redox homeosztázisa: a metabolikus
szindróma lehetséges terápiás célpontja
(Dr. Mandl József)
Az endoplazmás retikulum lumenében a citoplazmaitól elkülönült
piridin-nukleotid-készlet (NAD(P)-NAD(P)H) található. Ennek redukált
állapotát – ami elengedhetetlen a glukokortikoidok prereceptoriális
aktivációjához – elsősorban a hexóz-6-foszfát-dehidrogenáz tartja
fenn. Mivel az enzim a citoplazmából bejutó glukóz-6-foszfátot használ
fel, kulcsszerepet játszik az organellum tápanyagszenzor funkciójában.
In vivo kísérleteinben azt találtuk, hogy a táplálékfelvétel
nagymértékben befolyásolja az endoplazmás retikulum redox státusát.
Ennek megfelelően az organellum kortizoltermelő képessége jóllakott
állapotban nő, és éhezésben progresszíven csökken. Bizonyítottuk az
enzim „housekeeping” jellegét, ami összhangban van a tápanyagszenzor
funkcióval. Bemutattuk hogy a lokális kortizoltermelést ezekben a
sejtekben tehát a fruktóz-anyagcsere intermedierjei is serkenthetik,
ami részben megmagyarázhatja a fruktóz elhízásban és a diabétesz
kialakulásában játszott szerepét. Kimutattuk, hogy az ismert
antidiabetikus és elhízásgátló hatással rendelkező
epigallokatechin-gallát (EGCG) gátolja a máj mikroszóma
kortizoltermelését, és ezt a hatást – a metiraponhoz hasonlóan – nem a
részt vevő enzimek gátlása, hanem a luminális [NADPH]:[NADP] arány
csökkentése révén fejti ki. A megfigyelés alátámasztja, hogy az
endoplazmás retikulum luminális redox homeosztázisa potenciális
gyógyszertámadáspont az elhízással kapcsolatos
anyagcsere-betegségekben. A zsírsav-deszaturációban és a diabétesz
patomechanizmusában fontos szerepet játszó, újonnan azonosított
oxidoreduktáz, az Ncb5or természetes humán missense mutációit
vizsgálva megállapítottuk, hogy két Glu-Gly cserét okozó mutáció
gyorsítja a kódolt fehérje proteaszomális lebontását, és ezáltal
csökkenti az enzim féléletidejét. Sejtes és in vivo kísérleti
eredményekkel támasztottuk alá a H2O2 fehérje-tioloxidációban
betöltött szerepét. Kimutattuk, hogy az EGCG az ER-ben zajló
N-glikoziláció gátlása révén egyes fehérjéket a proteaszomális
lebontás felé terel, aminek szerepe lehet a katekinek daganatellenes
hatásában (Konta et al., 2011). Kiterjedt vizsgálatokat folytattunk a
BGP-15 inzulinérzékenyítő, HSP-indukáló molekula hatásainak
tisztázására. Kimutattuk, hogy a BGP-15 képes kivédeni egy
antipszichotikum, az olanzepin metabolikus mellékhatásait
(inzulinrezisztencia, elhízás). Kisérletesen indukált májkárosodásban
(acetaminofen) a BGP-15 anti-apoptolikus hatású volt, és ezt a hatását
a mitokondriális membrándepolarizáció befolyásolásán keresztül
fejtette ki. (Literáti-Nagy et al., 2010)
G-fehérjéhez kapcsolt receptorok
aktivációs modelljeinek elemzése
(Dr. Hunyady László)
A tervezett kutatás elvégzése érdekében olyan módszereket alkalmazunk,
illetve fejlesztünk ki, melyek segítségével nyomon tudjuk követni
különböző agonista, illetve antagonista vegyületek hatását a
receptorok által szabályozott jelátviteli folyamatok működésére.
Rezonancia energiatranszferen alapuló módszereket állítunk be, melyek
segítségével vizsgálni tudjuk különböző ligandok hatását a receptor
b-arresztin kötésére, cAMP- és MAP-kináz aktiváló képességére (Balla
et al., 2011). A 2-es típusú vazopresszin receptor (AVPR2)
veleszületett funkcióvesztéses mutációja nefrogén diabétesz
inszipidusz (nDI) klinikai képét okozza. Kísérleteink célja olyan
vazopresszin receptor agonisták azonosítása, melyek képesek egyes
betegséget okozó mutáns receptorok aktiválására. A receptor
működésének nyomon követése érdekében elkészítettük a vad típusú AVPR2
C-terminálisan fluoreszcens fehérjével (mVenus, corulean), valamint
lumineszcens fehérjével (Sluc) jelölt változatait. Mindezen jelölt
receptorokkal mérhetővé vált az agonista arginin-vazopresszin kezelés
hatására bekövetkező β-arresztin kötődés élő adherens, HEK-293
sejtvonalban (Ligeti et al., 2012). A fentiek mellett szükség van a
hormon celluláris jelátvitelének detektálására is. Mindehhez egy
holland kutatócsoport által elkészített, és rendelkezésünkre bocsátott
cAMP-függő Epac-aktiválódást mérő szondát alkalmazunk, amellyel
sejtpopuláció-szinten tudjuk a cAMP-szint változásait detektálni, így
a potenciális agonisták hatékonyságát vizsgálni. Kísérleteinkben az
intracelluláris cAMP-szint mérésére használt FRET- (fluoreszcencia
rezonancia energiatranszfer) alapú Epac-bioszenzor segítségével nem
tudtunk megfelelő jeleket detektálni. Ezért molekuláris biológiai
módszerekkel elkészítettük az Epac bioszenzor BRET- (biolumineszcencia
rezonancia energiatranszfer) alapú verzióját is, mivel a
BRET-módszeren alapuló mérések nagy előnye a FRET-mérésekkel szemben a
nagy érzékenység. A Semmelweis Egyetem II. Belgyógyászati Klinikájának
munkatársaival (Dr. Tóth Miklós, Dr. Patócs Attila, Prof. Dr. Rácz
Károly) együttműködve azonosítottunk egy kongenitális nDI-betegben
előforduló missense-mutációt az AVPR2 génjében. A mutáció (N321K) egy
aminosav cseréjét okozza a vazopresszin receptorban. Az előzetesen
létrehozott bioszenzorok (receptorfúziós fehérjék) mutagenezisével az
azonosított mutációt tartalmazó konstruktokat is elkészítettük.
Adataink szerint a mutációt tartalmazó receptor fiziológiás
koncentrációban adott vazopresszin, illetve a terápiában alkalmazott
dezmopresszin hatására nem hozta létre a vad típusú receptorra
jellemző cAMP-szint-emelkedést, receptor – β-arresztin kapcsolódást,
illetve MAP-kináz aktiválódást. További kísérleteinkben vizsgáljuk,
hogy a mutációt tartalmazó receptor milyen egyéb tulajdonságai
károsodtak, illetve különböző AVPR2-ligandokat használva keresünk
olyan farmakonokat, melyek az N321K-mutációt tartalmazó receptor
károsodott funkcióit helyreállítja. Beállítunk HEK293-sejtekből
kiindulva egy transzpozonos „Sleeping Beauty” (SB) rendszert, ahol az
AVPR2-mVenus DNS-t egy SB-CMV-EGFP-vektorba klónoztuk. Ezek
segítségével különböző mutáns receptorokat is tartalmazó sejtvonalakat
hozunk létre, és így lehetőség nyílik különböző vegyületek
AVPR2-aktiváló hatásának vizsgálatára.
Új metabolikus kutatások és eredményeik felhasználása a központi
idegrendszer neurodegeneratív betegségeinek
befolyásolásában
(Dr. Ádám-Vizi Veronika)
Izolált mitokondriumokban kimutattuk, hogy amikor az elektron
transzportlánc hibás vagy gátolt, azF80)F(1)ATPase revertál, és a
membránpotenciál megtartott mindaddig, amíg a matrix szubsztrát
foszforiláció működik, és nem következik be az adenin nukleotid
transzlokáz (ANT) reverziója. Ezt a folyamatot igazoltuk tenyésztett
neuronokban is, ahol a mitokondriumok légzési láncát blokkoltuk. A
jelenséget COS-7-sejtekben és asztrocitákban is kimutattuk.
Megfigyeléseink alapján létezik egy védőmechanizmus, amely gátolt
sejtlégzés esetében megakadályozza a citoszolikus és magi
ATP-depléciót.
Izolált aranyhörcsög-mitokondriumokon kimutattuk,
hogy nukleotidok jelenlétében a Ca2+ által indukált
ROS-felszabadulás membránpotenciál-függő: depolarizált mitokondriumok
esetében alig indukál a Ca2+ H2O2-felszabdulást.
Ugyanakkor erősen polarizált mitokondriumok esetében a Ca2+
nem indukál mitokondrális ROS-felszabadulást. A jelenség független a
mitokondrium membrán-permeabilitás változásaitól. Az
alfa-glicerofoszfát dehidrogenáz jelentős szerepet tölt be a
citoplazmában képződő NADH oxidálásában. Az enzim egy flavoprotein,
mely a mitokondrium belső membrán citoplazma felőli részén helyezkedik
el. Az enzimet kalciummal a citoplazma felől aktiválni lehet, és az
aktiválást jelentős mennyiségű ROS keletkezése kíséri. A ROS-k részben
a Komplex I-en, részben a mátrixban, részben pedig magán az
alfa-glicerofoszfát dehidrogenáz enzimen keletkeznek. Eddigi
vizsgálataink szerint az enzim Na+-mal való aktivációja fokozza mind a
mitokondriális ATP-, mind a mitokondriális ROS-képzést.
A továbbiakban a kalcium szerepét vizsgáltuk a
reaktív oxigénszármazék-keletkezésben. Megállapítottuk, hogy az
alkalmazott kísérleti körülményektől
(alfa-glicerofoszfát-koncentráció, kalciumkoncentrációk) függően a
ROS-képzésben három mechanizmus játszik szerepet: a reaktív
oxigénszármazékok részben a komplex I-en, részben a mátrixban, részben
pedig magán az alfa-glicerofoszfát dehidrogenáz enzimen keletkeznek.
Tanulmányoztuk a metilmalonsav hatását a mitokondriális
metabolizmusra, és megállapítottuk, hogy gátolja a szukcinát
dehidrogenáz enzimet, valamint egy új, a citrát kör
sebességmeghatározó lépését aktiváló hatással is bír.
A metil-malonsav (MM) számos katabolikus folyamat
közös intermediere, felhalmozódása azonban súlyos, idegrendszeri
tünetekkel is járó kórkép okozója. A betegségben a mitokondriumok
diszfunkciójára utaló jelek is megfigyelhetők. Megállapítottuk (az
irodalmi adatokkal összhangban), hogy a MM gátolja a szukcinát
oxidációját, a gátlás kompetitív jellegű. Érdekes, új megfigyelésünk,
hogy a MM hatására az alfa-ketoglutarát (a-KG) oxidációja
szignifikánsan fokozódik. A MM oxidációt fokozó hatása tükröződik az
ATP-termelés fokozódásában és a DYm hiperpolarizációjában is. A
jelenséget magyarázhatja, hogy i) a MM fokozza az a-KG mitokondriális
transzportját, ii) a mitokondriumokhoz adott MM maga is aktiválódik,
és oxidálódik, iii) a MM fokozza az a-KGDHc aktivitását.
Eredményeinket úgy interpretáljuk, hogy a MM hatására legvalószínűbben
az a-KG mitokondriális transzportja aktiválódik, de nem zárható ki a
szukcinil-CoA – acetacetát transzferreakció analógiájára a
szukcinil-CoA – metilmalonil-CoA transzfer lehetősége sem.
Eredményeink arra utalnak, hogy az extracelluláris MM csak lassan jut
be a sejtekbe, és a sejtkárosodást az intracellulárisan termelődő és
nem a keringéssel transzportálódó MM okozza.
Elemeztük a dihidrolipoamid dehidrogenáz (LADH)
patogén mutációinak funkcionális következményeit expressziós
vektorban. Négy mutáció az LADH enzimaktivitásának csökkenésével, de
ROS-generáló képességének fokozódásával járt. A genetikai változások
nem eredményeztek konformációs eltéréseket. Az emberi LADH-hiányos
betegségekben az antioxidáns terápia racionális megközelítés lehet
(Ambrus et al., 2011).
A ciclofilin-D- (CD) hiányos egerek rezisztensek a
fokális agyi isémiára és nekrózisra, de érzékenyek maradnak
apoptózisra. A jelenséget agyszövetben, illetve izolált neuron és
asztrocita mitokondriumokon elemeztük. A Ca2+ CD-függő
módon indukált mitokondriális duzzadást, melyet complex I gátlás
felfüggesztett. Asztrocitában, illetve neuronokban a CD eltérően vett
részt a mitokondriális duzzadásban. Neuronokban a CD-hiányos
mitokondriumok glutamátindukált duzzadása késleltetett volt. Ezen
megfigyelések azt igazolják, hogy bizonyos körülmények között a CD véd
agyi nekrózis kialakulása ellen (Doczi et al., 2011).
Mikrovezikulum mint új terápiás
támadáspont a szepszis kezelésében
(Dr. Ligeti Erzsébet)
Kimutattuk, hogy izolált neutrofil granulociták különböző stimulusok
hatására mikrovezikulumokat képeznek, amelyek bizonyos körülmények
között baktériumok növekedését képesek gátolni. Összehasonlítottuk az
antibaktériális hatással rendelkező, valamint az antibaktériális
hatást nem mutató mikrovezikulumokat. Áramlási citométerben nem
találtunk különbséget a méret és granuláltság tekintetében. Az
antibakteriális hatást mutató és azzal nem rendelkező mikrovezikula
populáción proteomikai elemzést végeztünk. Mindegyik preparátumban 90
fehérjét sikerült 98%-os biztonsággal azonosítani: ezek között a
legnagyobb mennyiségben antibakteriális fehérjéket, felszíni adhéziós
proteineket, metabolikus enzimeket, valamint a citoszkeleton
alkotórészeit találtuk. A proteomikai analízis sem HLA-antigéneket,
sem NADPH oxidáz komponenseket nem talált. Ezen vizsgálatok alapján
kimondhatjuk, hogy az általunk felfedezett mikrovezikulumok
nemoxidatív mechanizmussal gátolják a baktériumok szaporodását.
Kimutattuk, hogy glukóz hiányában elvész ezen mikrovezikulumok
baktériumnövekedést gátló hatása. Részletesen megvizsgáltuk a
proteomikai analízis eredményeit, és azt tapasztaltuk, hogy az
antibakteriális hatással rendelkező mikrovezikulumokban számos,
eredetileg neutrofil granulumban elhelyezkedő protein bedúsult.
Megállapítottuk, hogy az antibaktériális hatással rendelkező
vezikulákban legalább 50%-os dúsulást tapasztaltunk 29 fehérje
esetében. Ezek közül 26 fehérje a neutrofil granulociták különböző
granulum-populációinak ismert összetevője (például lactoferritin és
myeloperoxidase, 4. ábra), tehát opszonizált részecske
fagocitózisa során a keletkező mikrovezikulumokba halmozottan jutnak
be a granulumok (Csépányi-Kömi et al., 2011). A proteomikai elemzés
eredményét sikerült immunblottal megerősíteni a laktoferrin, valamint
a mieloperoxidáz esetében. Immun-fluoreszcens vizsgálatokat végeztünk
a granulumfehérjék vezikulán belüli lokalizációjának kimutatására.
Nyugvó vezikulumban a mieloperoxidáz enzim csak a vezikula
permeabilizálását követően festődik, tehát egyértelműen a vezikula
belsejében helyezkedik el. A mikrovezikulumok eltarthatóságának
vizsgálatában kimutattuk, hogy egy hétig -20 oC-on történő tárolás –
amit az exoszomák esetében más munkacsoportok kiterjedten alkalmaznak
– az antibakteriális hatás elvesztését eredményezi. Az antibakteriális
hatás specificitásának igazolására kimutattuk, hogy a kontroll
vezikulumok számának növelésével nem lehetséges antibakteriális hatást
elérni. A mikrovezikulumok gátolják az S. aureus és az E. coli
növekedését, de nem hatásosak például a P. mirabilis ellen,
antibakteriális hatásuk tehát bizonyos szelektivitást mutat.
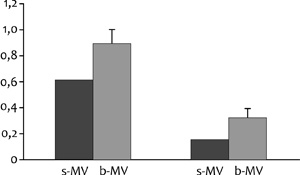
4. ábra • Antibakteriális mikrovezikulumok
(b-MV) lactoferritin- és myeloperoxidase-tartalma
Eredmények számokban
A kutatásokban tizenhárom főállású és huszonhárom részfoglalkozású
kutató vett részt, tizenhárom új PhD-hallgató mellett. A kutatási
eredményekről hatvanhat nemzetközi közlemény és harminchárom
nemzetközi konferencia előadása ad számot, míg ezekből két szabadalom
is született.
A résztvevők bemutatása
A Semmelweis Egyetem II. számú Patológiai Intézete az ország egyik
meghatározó patológiai intézménye. Vezetője Dr. Tímár József, az MTA
doktora. Hazai referenciaközpont az emlőrákok, a gasztrointesztinális-
és urogenitális-, tüdő- és májdaganatok terén. Fő kutatási területek:
a daganatok ereződése és az áttétképzés genetikája (vezetője Dr. Tímár
József), a hepatokarcinogenezis (vezetője Dr. Schaff Zsuzsa
akadémikus) és az emlőrák molekuláris patológiája (vezetője Dr. Kulka
Janina egyetemi tanár). Közös kutatásokat végez az Semmelweis Egyetem
I. számú Gyermekgyó-gyászati Klinika MTA-kutatócsoportjával (Dr.
Győrffy Balázs). Ezen kutatásokat három MTA doktori, kilenc
PhD-fokozattal rendelkező kutató és hét PhD-hallgató végzi.
A Semmelweis Egyetem I. számú Patológiai és
Kísérleti Rákkutató Intézete tíz éve tölti be a Magyarországi
Onkohematológiai Centrum szerepét, vezetője Dr. Matolcsy András, az
MTA doktora. Az onkohematológiai diagnosztikát az intézet „komplex”
módon, morfológiai, citogenetikai, áramláscitometriai, és molekuláris
módszerekkel végzi. Az onkohematológiai diagnosztikát mintegy tizenöt
munkatárs, köztük három minősített orvos, három minősített biológus és
kilenc technikus végzi. A munkacsoportot akadémiai doktor, egyetemi
tanár vezeti. Az onkohematológiai munkacsoport egyik legfőbb feladata
a hematológiai diagnosztika folyamatos fejlesztése, és a fejlesztések
bevezetése a mindennapi rutin diagnosztikába.
A Semmelweis Egyetem Orvosi Biokémiai Intézet
1996-ban kapta jelenlegi elnevezését. Az intézetet hagyományai a
metabolikus, az idegrendszeri és a hemosztázis kutatásokhoz kötik. Az
intézet igazgatója 1990-től Ádám Veronika, az MTA rendes tagja.
Irányítása alatt vált a neurobiokémia az intézet meghatározó
profiljává, és szintén ő a vezetője az intézetben működő MTA
Neurobiokémiai kutatócsoportjának is. A Neurokémiai munkacsoport
vizsgálja a neurodegenerációban és stroke-ban szerepet játszó
bioenergetikai folyamatokat.
A Semmelweis Egyetem Orvosi Vegytani, Molekuláris
Biológiai és Patobiokémiai Intézet vezetője Dr. Mandl József, az MTA
tagja. Az intézetben működő munkacsoportok többek között a metabolikus
szindróma különböző aspektusait vizsgálják, így az endoplazmás
retikulum stressz, a humán genetikai polimorfizmusok szerepét, a
chaperonok működését, a kinázgátló vegyületek lehetséges alkalmazását;
emellett nagyobb, hálózatkutatással és tirozin kinázokkal foglalkozó
munkacsoportok is működnek. Az intézet kutatói a közelmúltban két
magyar fejlesztésű molekula sikeres, klinikai fázis-II vizsgálatának
előkészítésében vettek részt. Az ER-stressz befolyásolásával, illetve
kinázgátló molekulák hatásvizsgálatával preklinikai vizsgálatokat
végeznek cukorbetegség-ellenes szerek kutatásában. Több EU-pályázatban
– köztük két nanotechnológiai – pályázatban vesznek részt intézeti
kutatók.
A Semmelweis Egyetem Élettani Intézetében
nemzetközi szinten is elismert kutatási és fejlesztési tevékenység
folyik. Az intézet vezetője Dr. Hunyady László, az MTA levelező tagja.
A hazai pályázati források mellett az intézet kutatói olyan jelentős
nemzetközi támogatásokat nyertek el, mint a European Research Council,
a Wellcome Trust, a Howard Hughes Medical Institute, illetve az MTA
Lendület programjának támogatása, és az elmúlt években több sikeres
NKTH által támogatott fejlesztési projekt is megvalósult. Az intézet
több EU-pályázat megvalósításában vesz részt, melyek közül közül a
Tarkinaid projektben a konzorcium vezetője Dr. Mócsai Attila, az
Élettani Intézet egyetemi docense. Dr. Hunyady László akadémikus a
G-fehérjéhez kapcsolt receptorok kutatásának nemzetközileg elismert
képviselője. Dr. Ligeti Erzsébet akadémikus munkacsoportja a kis
G-fehérjék és ezek működését szabályozó elemeket kutatja, illetve
vizsgálják a NADPH-oxidáz enzim szerepét az immunvédekezésben.
Kulcsszavak: molekuláris terápia, daganat, gazdaszervezet
IRODALOM
Ambrus A. – Törőcsik B. – Tretter L. –
Ozohanics O. – Ádám-Vizi V. (2011): Stimulation of Reactive Oxygen
Species Generation by Disease-Causing Mutations of Lipoamide
Dehydrogenase. Human Molecular Genetics. 20, 2984–2995.
Balla A. – Erdélyi L. S. – Soltész-Katona
E. – Balla T. – Várnai P. – Hunyady L. (2011): Demonstration of
Angiotensin II-induced Ras Activation in the Trans-Golgi Network and
Endoplasmic Reticulum Using Bioluminescence Resonace Energy
Transfer-Based Biosensors. Journal of Biological Chemistry. 286,
5319–5327.
Balogh Zs. – Reiniger L. – Rajnai H. –
Csomor J. – Szepesi Á. – Balogh A. – Deák L. – Gagyi É. – Bödör Cs. –
Matolcsy A. (2011): High Rate of Neoplastic Cells with Genetic
Abnormalities in Proliferation Centers of Chronic Lymphocytic
Leukemia. Leukemia & Lymphoma. 52, 1080–1084.
Csépányi-Kömi R. – Sirokmány G. – Geiszt
M. – Ligeti E. (2011): ARHGAP25, A Novel Rac GTPase Activating Protein
Regulates Phagocytosis in Human Neutrophilic Granulocytes. Blood. 119,
573–582.
Doczi J. – Turiak L. – Vajda S. – Mandi M.
– Torocsik B. – Gerencser A. A . – Kiss G. – Konrad C. – Adam-Vizi V.
– Chinopoulos, C. (2011): Complex Contribution of Cyclophilin D to
Ca2+-Induced Permeability Transition in Brain Mitochondria, with
Relation to the Bioenergetic State. Journal of Biological Chemistry.
286, 6345–6353.
Győrffy B. – Benke Zs. – Lánczky A. –
Balázs B. – Szállási Z. – Tímár J. – Schäfer R. (2012): Recurrence
Online: an online analysis tool to determine breast cancer recurrence
and hormone receptor status using microarray data. Breast Cancer
Research Treatment. (epub)
Konta L. – Száraz P. – Magyar J. E. –
Révész K. – Bánhegyi G. – Mandl J. – Csala M. (2011): Inhibition of
Glycoprotein Synthesis in the Endoplasmic Reticulum as a Novel
Anticancer Mechanism of (-)-Epigallocatechin-3-gallate. Biofactors.
37, 468–476,
Ligeti E. – Welti S. – Scheffzek K.
(2012): Inhibition and Termination of Physiological Responses by
GTPase Activating Proteins. Physiological Reviews. 92, 237–272.
Literáti-Nagy B. – Péterfai E. – Kulcsár
E. – Literáti-Nagy Z. – Buday B. – Tory, K. – Mandl J. – Sümegi B. –
Fleming, A. – Roth J. – Korányi L. (2010): Beneficial Effect of the
Insulin Sensitizer (HSP Inducer) Bgp-15 on Olanzapine-induced
Metabolic Disorders. Brain Research Bulletin. 83, 340–344.
Patonai A. – Erdélyi-Belle B. – Korompay
A. – Somorácz A. – Straub B. K. – Schirmacher P. – Kovalszky I. – Lotz
G. – Kiss A. – Schaff Zs. (2011): Claudins and Tricellulin in
Fibrolamellar Hepatocellular Carcinoma. Virchows Archiv. 458, 679–688.
Rajnai H. – Bödör Cs. – Balogh Z. – Gagyi
E. – Csomor J. – Krenács T. – Tóth E. – Matolcsy A. (2012): Impact of
the Reactive Microenvironment on the Bone Marrow Involvement of
Follicular Lymphoma. Histopathology. (epub)
Szász A. M. et al. (2011): Identification
of a Claudin-4 and E-cadherin Score to Predict Prognosis in Breast
Cancer. Cancer Science. 102, 12, 2248–2254.
Tímár J. – Győrffy B. – Rásó E. (2010):
Gene Signature of the Metastatic Potential of Cutaneous Melanoma.
Clinical & Experimental Metastasis. 27, 371–387.
Zádori G. – Gelley F. – Törzsök P. –
Sárváry E. – Doros A. – Deák A. P. – Nagy P. – Schaff Zs. – Kiss A. –
Nemes B. (2011): Examination of Claudin-1 Expression in Patients
Undergoing Liver Transplantation Owing to Hepatitis C Virus Cirrhosis.
Transplantation Proceedings. 43: 1267–1271.
|