|
megőrizni a tetraéderes elrendeződést. A
hexagonális jég sűrűsége 0 °C-on 0,917 g/cm³, a jég X pedig 2,8 g/cm³
fölötti sűrűségekben stabil. Ennek az eredménye, hogy egészen
különleges szerkezeteket képeznek.
A hexagonális jég 4. ábrán bemutatott
szerkezetét felülről elképzelve szabályos hatszögeket kapunk. A
kapcsolat a jég II és az Ih jég között úgy képzelhető el, hogy
különválasztjuk a hexagonális Ih gyűrűket, az eredeti síkból fel-,
illetve letoljuk a szomszédosakat, elfordítjuk őket 30°-kal, és
összekapcsoljuk a hidrogénkötéseket. Ez a szerkezet 1,16 g/cm³
körüli sűrűséget ad. A további szerkezetek egyre
bonyolultabban magyarázhatók el. A jég III esetében öt tagból áll
a gyűrű, a jég IV esetében tizennégy, a jég V esetében pedig már
huszonnyolc molekulát tartalmaz az elemi cella. A jég V módosulatban
már nem is ekvivalens a vízmolekulák helyzete, a hidrogénkötések
szögei is változnak. A jég VI forma 6. ábrán
látható vetületének sajátsága, hogy a hidrogénkötések már nem
tetraéderes (109,47°), hanem 60°-os szöget zárnak be. Az Ih esetében
egy vízmolekulát mint egy tetraéder középpontját tekinthettük,
amelyből a tetraéder négy csúcsa felé működtek a hidrogénkötések. A
jég VI esetében a molekulák csak a tetraéderek csúcsán vannak. Ez az
utolsó fázis, ahol még nincsenek ún. kontakt párok, azaz olyan
vízmolekula-szomszédok, amelyeknél az oxigén–oxigén távolság azonos a
hidrogénkötésben lévő és nem lévő szomszédokra is.
A jég VII nagyon nagy nyomásokon stabil. Itt már az
anyag sűrű (1,4−2,8 g/cm³), és ahogyan az 1. ábra mutatja, a
kocka közepén elhelyezkedő víz-molekula szabályos tetraéderes
hidrogénkötésekkel kapcsolódik négy szomszédjához. Van azonban további
négy, kölcsönhatási szempontból előnytelen kontakt molekula is.3
Ha összehasonlítjuk a jég VII szerkezetét a szintén köbös szimmetriájú
Ic módosulatéval (7. ábra), akkor látható, hogy utóbbiban az
üres gömbként jelölt oxigénatomok a nyolc kis kockából csak minden
másodikban fordulnak elő, és ugyanaz a kapcsolódási viszonyuk, mint a
hexagonális jégé. Nem véletlenül, az Ic módosulat az Ih metastabil
párja, a sűrűségük is közel azonos.
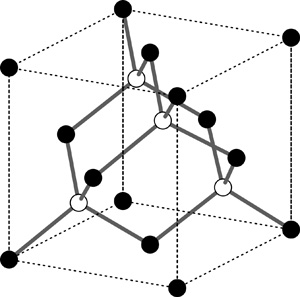
7. ábra • A jég Ic módosulatának a
szerkezete olyan, mintha az oxigéneket egy gyémántrács pozícióiba
helyeztük volna. A kockán belüli oxigéneket üres gömbbel jelöltük. A
hidrogéneket nem mutatjuk.
A jég kristályos módosulatainak sokfélesége is jól
mutatja a víz rendkívül változatos viselkedését. Ez a rendkívüliség
azonban a víz szinte minden tulajdonságában jelen van. Ha egy
„rendesen” viselkedő analóggal, a metánnal vetjük össze, akkor több
mint hatvan tulajdonságáról mondhatjuk el, hogy anomális. A „normális”
viselkedésű anyagokban ugyanis a tulajdonságok a hőmérséklet vagy a
nyomás függvényében monoton csökkennek, vagy nőnek, szemben a víz
számos szélsőértéket (maximumot vagy minimumot) mutató viselkedésével.
Közismert a két legszembetűnőbb sűrűséganomália: a víz 4 °C- on a
legsűrűbb, és a fagyáskor keletkező kristályos fázis, a hexagonális
jég sűrűsége jóval kisebb, mint a vízé. (Ezért tud kitelelni a tavak
élővilága.)
A további anomáliákra csak néhány
példát említünk. Az XH2 illetve YH4 típusú
molekulák egy atmoszférán mért olvadás- és forráspontja,
valamint a kritikus hőmérsékletük a molekula atomi tömegének
növekedésével általában emelkedik (például a szénoszlop esetében).
Eltérő azonban a víz viselkedése. A vízre mind a három hőmérséklet
drasztikusan nagyobb, mint amekkorát a molekulatömege alapján
várhatnánk.
A 8. ábrán egy sor
tulajdonságot ábrázoltunk a hőmérséklet függvényében, kiterjesztve a
skálát a víz túlhűtött tartományára is.4 A
függőleges tengelyen nincs se mérőszám, se mértékegység, mivel
különböző mennyiségeket vetünk össze, és csak a relatív változásokra
vagyunk kíváncsiak. Úgy transzformáltuk a tulajdonságok számértékeit,
hogy -30° és 100 °C között a legmagasabb érték 1, a legalacsonyabb
pedig 0 legyen. A vékony, folytonos vonal (F-jelű görbe) jelzi a víz
sűrűségének változását. Jól megfigyelhető a 4 °C-nál
tapasztalt maximum. Valójában 0 és 100 °C között a víz sűrűségének
változása mérsékelt, az ebben az ábrázolásban egynek látszó különbség
mindössze ~4%, ami igen előnyös a mindennapi életben (például
hőcserélők, főzés). Az A-val jelölt szaggatott görbe jelzi az izobár
hőkapacitás függését.5 Ennek a
mennyiségnek minimuma van 40 °C körül. A vastag, folytonos vonal (B
görbe) az izoterm kompresszibilitás
(összenyomhatóság) relatív viselkedését mutatja. A görbének minimuma
van 50 °C közelében. A C-vel jelölt szaggatott görbe a hőtágulást
ábrázolja, ami ebben az ábrázolásban telítési görbe szerint
viselkedik. A vastag pontozott vonal (D görbe) a hangsebesség
maximumát jelzi 70−80 °C környékén. A vastag szaggatott vonal (E
görbe) a viszkozitásnak a nyomással való változását mutatja.6
Ez a görbe telítési jellegű.
A fentieken túlmenően lényeges, hogy a víznek nagy
a hőkapacitása, ami stabilizálja a testhőmérsékletet, továbbá nagy a
dielektromos állandója, ami erőteljesen árnyékolja a szervezetben lévő
sok-sok ion hosszú távú kölcsönhatását. Enélkül a töltések közötti
távolra ható erő mindenképpen a lokális és érzékeny molekuláris
történések gátja lenne.
E néhány példából is látható, hogy a víz számos
tulajdonsága különleges karaktert kölcsönöz ennek az anyagnak. A
legújabb elmélet szerint a víz üveges fázisainak a tanulmányozása
értelmezhetővé teszi ezeket a szélsőértékeket. A feltevés szerint a
víznek túlhűtött állapotban van egy további kritikus pontja, ahol két
folyadékfázis van egyensúlyban. Mivel a feltevés szerinti körülmények
között (-(90−50) °C és 2000−3400 atm) a víz nem állítható elő, a 0,94
g/cm³ sűrűségű és az 1,17 g/cm³ sűrűségű üveges fázisok keletkezési
helyében látják a bizonyítékot. Az üvegek ugyanis a túlhűtött víz
inherens szerkezetét mutatják, tehát a második kritikus pont helye az
üvegek keletkezési tartományából megállapítható. Az elméletnek nemcsak
az az érdekessége, hogy a második kritikus pontig húzott görbék
mintegy értelmeznék a sok, most speciálisnak tűnő viselkedést, hanem
maga az a feltételezés is, hogy egyetlen kémiai anyagnak
folyadékállapotban van folyadék–folyadék egyensúlya. A kémia eddig
ilyen példával még nem találkozott, egy adott hőmérsékleten és
nyomáson minden egykomponensű folyadék egyetlen fázist alkot.
Bár a vízről nagyon sok kísérleti információval
rendelkezünk, még mindig vannak megválaszolatlan kérdések. A víz
szerkezetéről készült neutron-, illetve röntgenszórási kísérletek
alapján csak O-O, O-H és H-H pártávolság statisztikák ismeretesek elég
nagy bizonytalansággal. Nem ismert a molekulák folyadékfázison belüli
dipóluseloszlása és polarizálhatósága.
Nélkülözhetetlenek azok az elméleti módszerek,
amelyek kísérleteket tudnak kiváltani. A kvantumkémiai programok – egy
ilyen kis molekulára – már nagy pontossággal számítják a molekula gáz
állapotú energiaszintjeinek értékeit kísérletileg hozzáférhetetlen
hőmérséklet-tartományokban is. A klasszikus mechanikán és
elektrosztatikán alapuló modellezési eljárások egyre pontosabban írják
le vizes molekulák halmazainak viselkedését. Megfelelő
paraméterezéssel a polarizálható molekulák a híg gőztől a nagynyomású
jégfázisokig adnak igen jó közelítéseket. A modellezés nemcsak a víz
tulajdonságainak megértése szempontjából fontos, de lehetővé teszi,
hogy a molekula viselkedésének jóslása változatos körülmények
(biomolekulák, ásványok) között is megbízható legyen. Így bonyolult
rendszerek viselkedése is érthető lesz.
Kulcsszavak: víz, jég, fázisdiagram, anomális viselkedés, második
kritikus pont
LÁBJEGYZETEK
1 Innen jön az elnevezés
is: az olvasztott üveget nagyon lassan kell hűteni, hogy rendezett
szerkezetű kvarckristály keletkezzen belőle.
<
2 Ez azt jelenti, hogy
speciális körülmények között keletkezhetnek, és huzamosabb ideig
fennmaradhatnak, de az adott nyomáson és hőmérsékleten van olyan
fázis, amely termodinamikai értelemben alacsonyabb potenciálon
található, vagyis „normális” esetben a stabil fázis keletkezik.
<
3 A félig befestett kis
gömbpárok arra utalnak, hogy egy rendezetlen fázis esetén a mérés
alapján a proton 50%-os valószínűséggel kapcsolódhat mindkét
hidrogénkötésben lévő molekulához.
<
4 A folyadékok
túlhűthetők, ha megakadályozzuk a kristálygócok keletkezését, amelyen
a kiválás elkezdődne. Ekkor a folyadék metastabil állapotban van.
<
5 A hőkapacitás azt méri,
hogy egységnyi hőmérséklet-emelkedéshez mennyi hőt kell közölni a
rendszerrel.
<
6 Viszkozitás a folyadékok
vagy gázok ellenállása nyírófeszültséggel szemben. Nem keverendő össze
a sűrűséggel. A méz például nem nagyon sűrű, folyása mégis nagyon
viszkózus a vízhez képest.
<
|