|
OH-csoportok kémiai módosítása nélkül is
nagyságrendekkel többféle szerkezet kialakítására képesek, mint a
nukleotidok és a peptidek. Ez akkora kódolási kapacitást rejt, amely
mindenképpen alkalmas lehet a sejtspecifikus információk tárolására és
megjelenítésére.
Az információhordozó kapacitás tovább növekszik a
harmadik dimenzióban (5. ábra). A monoszacharidokat
összekapcsoló Φ és Ψ kötések mentén a cukoregységek elfordulhatnak
(szabatosan a Φ és Ψ az elfordulás során változó diéderes vagy torziós
szögeket jelöli). Az így létrejövő téralkatok (konformerek) között
azonban több, kb. azonos energiatartalmú kitüntetett elrendeződés is
található, amelyek eltérő alakját más és más lektin képes felismerni.
Ily módon ugyanaz a szénhidrátkulcs több zárat is nyithat (Gabius et
al., 2004).
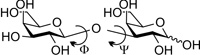
5. ábra • A téralkat (konformáció) változása
a glikozidos kötés mentén
Az ismert információhordozó oligoszacharidok
jelentős hányada tartalmaz legalább egy elágazást, de nem ritka a 2–4
elágazási pont sem (Werz et al. 2007). Ennek eredményeként ezek a
vegyületek a sejt felszínén mintegy „antenna” formájában jelennek meg
(6. ábra). Mivel a lektinreceptorokhoz való kötődésben
elsősorban a láncok végén helyet foglaló
cukoregységek vesznek részt, ennek a többértékűségnek
(multivalenciának) a következménye a kölcsönhatás 10–100 000-szeres
erősödése az önmagában kötődő monoszacharidhoz képest (glikozid
klaszter vagy kelát effektus) (Lundquist – Toone, 2002).
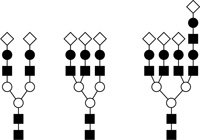
6. ábra • Az oligoszacharid-antennák (az
egyes alakzatok különböző monoszacharid egységeket jelképeznek)
Gyakran felmerülő kérdés, hogy a genom és a proteom
– mint az élő szervezetek alapvető információs és funkcionális
molekuláinak összessége – tanulmányozásában elért impozáns áttörések
mellett miért szerényebbek a glikom kutatásának eredményei. „Az
egyszerű válasz az, hogy a glikokonjugátumok sokkal bonyolultabbak és
változatosabbak a fehérjéknél és nukleinsavaknál, és vizsgálatuk jóval
nehezebb.”1
(Roseman, 2001) A szerkezeti és funkcionális sokféleség felderítésére
számos vizsgáló módszer összehangolt alkalmazása szükséges. A
természetes forrásokból való elkülönítés és szerkezetmeghatározás
legfontosabb eszközei a nagyhatékonyságú folyadékkromatográfia,
illetve ennek tömegspektrometriával kapcsolt változatai (HPLC/MS),
mágneses magrezonancia spektroszkópia (NMR), szénhidrátokat kötő
fehérje array-k, szénhidrát-array-k, a molekulamodellezés (Pilobello
– Mahal, 2007). Szükséges a megismert szerkezetek sejt- és
szövetkönyvtárakba/adatbázisokba rendezése és informatikai kezelése
(Turnbull – Field, 2007). Mindezek mellett és után – mivel az
izolálható anyagmennyiségek általában nem elegendőek a funkció
tanulmányozására – a szintetikus szénhidrátkémia feladata
• a természetes vegyülettípusok (pl.
oligoszacharidok, glikoproteinek, glikolipidek), és/vagy lényegi
alkotóelemeik (például N- és O-glikozilezett aminosavak, peptidek)
előállítása célszerűen automatizált módszerekkel, amelyek fejlettsége
jelenleg jóval elmarad a fehérjék és nukleinsavak esetében
rutinszerűen alkalmazottaktól;
• mimetikumok (a természetben található anyagokkal
szerkezetükben és/vagy hatásukban analóg vegyületek: pl. C-glikozil
származékok) készítése (Bernardi – Cheshev, 2008);
• inhibitorok tervezése és szintézise, melyek a
természetes folyamatokba való beavatkozás lehetőségét adhatják.
A szénhidrátkód megismerésének része a
glikán–fehérje kölcsönhatások funkcionális feltérképezése, melynek
során a fehérje-krisztallográfia, NMR-spektroszkópia, felületi
plazmonrezonancia, kalorimetria, változatos számítási kémiai módszerek
szinergisztikus alkalmazása szükséges (DeMarco – Woods, 2008). A
funkcionális glikomika és lektinomika ezek után szénhidrát-alapú
vakcinák (Seeberger – Werz, 2007), diagnosztikumok és gyógyszerek
előállítását alapozhatja meg (Turnbull – Field, 2007); lehetővé tehet
szinte mellékhatások nélküli sejt- vagy szövetspecifikus terápiás
módszereket (Davis, 2000); igen pontos hatóanyag-célbajuttatást
(Gabius, 2000); hozzájárulhat az antibiotikum-rezisztencia
leküzdéséhez (Ritter and Wong 2001). A gyógyszerkémiai szemlélet
változását is eredményezhetik a glikomika meggyőző eredményei:
manapság a szénhidrátok jószerivel kívül esnek e terület érdeklődési
körén a vegyületek bonyolultsága, a várható technológiai nehézségek és
a hidrofil jelleg miatt korlátozott biológiai hozzáférhetőség okán.
A vázolt nehézségek és komplexitás dacára már ma is
léteznek szénhidrát-alapú, vagy szénhidrátokat utánzó szerkezetű
gyógyszerek, melyek megalkotásában (legalábbis részben) már a
glikobiológia és glikomika eredményei is fontos szerepet játszottak.
Így a cukorbetegség kezelésében alkalmazott Glucobay™ (Acarbose)
pszeudo-tetraszacharid szerkezetű, míg a Glyset™ (Miglitol) és a
Basen® (Voglibose) glikomimetikumnak tekinthető enzimgátlók. Szintén
glikoenzim (neuraminidáz) gátlók az influenza ellen alkalmazható
Relenza® (Zanamivir; módosított monoszacharid) és Tamiflu®
(Oseltamivir; glikomimetikum) is. A véralvadásgátló heparin
szintetikus helyettesítője az Arixtra® (Fondaparinux;
pentaszacharid), melyet nagyipari módszerekkel készítenek.
A szénhidrátkód megfejtése és működésének megértése
a nukleinsavak és fehérjék funkcióinak ismerete mellett, illetve
azokkal együtt adhatja kezünkbe azokat az eszközöket, melyekkel az
életjelenségeket a mainál magasabb szinten magyarázhatjuk, és szükség
esetén értően és tudatosan befolyásolhatjuk. Ezek az információk új
irányokat szabhatnak számos betegség terápiás megközelítésében és a
gyógyszerfejlesztésben is (Wong, 2003).
Kulcsszavak: cukrok, glikokonjugátumok; glikobiológia, glikomika,
sejtspecifikus felismerés, szénhidrát gyógyszerek
IRODALOM
Bernardi, Anna – Cheshev, Pavel (2008):
Interfering with the Sugar Code: Design and Synthesis of
Oligosaccharide Mimics. Chemistry-A European Journal. 14, 25,
7434–7441.
Davis, Benjamin G. (2000): Hand in Glove.
Chemistry & Industry. 4, 134–138.
Demarco, Mari L. – Woods, Robert J.
(2008): Structural Glycobiology: A Game of Snakes and Ladders.
Glycobiology. 18, 6, 426–440.
Dwek, Raymond A. (1996): Glycobiology:
Toward Understanding the Function of Sugars. Chemical Reviews. 96,
683–720.
Gabius, Hans-Joachim (2000): Biological
Information Transfer beyond the Genetic Code: The Sugar Code.
Naturwissenschaften. 87, 3, 108–121.
Gabius, Hans-Joachim – Siebert, H. C. –
André, S. – Jiménez-Barbero, J. – Rüdiger, H. (2004): Chemical Biology
of the Sugar Code. Chembiochem. 5, 6, 741–764.
Laine, Roger A. (1997): Information
Capacity of the Carbohydrate Code. Pure and Applied Chemistry. 69,
1867–1873.
Lichtenthaler, Frieder W. (2004):
Carbohydrates As Raw Materials for Chemical Industry. Collection of
Lectures of the Summer Schools on Green Chemistry. Green Chemistry
Series. (Tundo, Pietro ed.) Venice, 105–27.
Lundquist, Joseph J. – Toone, Eric J.
(2002): The Cluster Glycoside Effect. Chemical Reviews. 102, 555–578.
Nelson, David L. – Cox, Michael M. (2005):
Lehninger Principles of Biochemistry. W. H. Freeman and Company, New
York
Pazur, John H. (1998): Anti-Carbohydrate
Antibodies with Specificity for Monosaccharide and Oligosaccharide
Units of Antigens. Advances in Carbohydrate Chemistry and
Biochemistry. Academic Press, 53, 201–261.
Pilobello, Kanoelani T. – Mahal, Lara K.
(2007): Deciphering the Glycocode: The Complexity and Analytical
Challenge of Glycomics. Current Opinion in Chemical Biology. 11, 3,
300–305.
Ritter, Thomas K. – Wong, Chi-Huey H.
(2001): Carbohydrate-Based Antibiotics: A New Approach to Tackling the
Problem of Resistance. Angewandte Chemie-International Edition. 40,
19, 3509–3533.
Roseman, Saul (2001): Reflections on
Glycobiology. Journal of Biological Chemistry. 276, 45, 41527–42.
Seeberger, Peter H. – Werz, Daniel B.
(2007): Synthesis and Medical Applications of Oligosaccharides.
Nature. 446, 7139, 1046–1051.
Turnbull, Jeremy E. – Field, Robert A.
(2007): Emerging Glycomics Technologies. Nature Chemical Biology. 3,
2, 74–77.
Varki, Ajit (1993): Biological Roles of
Oligosaccharides: All of the Theories Are Correct. Glycobiology. 3,
97–130.
Werz, Daniel. B. – Ranzinger, R. – Herget,
S. – Adibekian, A. – von der Lieth, C. W. – Seeberger, P. H. (2007):
Exploring the Structural Diversity of Mammalian Carbohydrates
(„Glycospace”) by Statistical Databank Analysis. ACS Chemical Biology
2, 10, 685–691.
Wong, Chi-Huey (2003): Carbohydrate-Based
Drug Discovery. Wiley-VCH, Weinheim,
WEBCÍM >
1 „The simple answer is
that glycoconjugates are much more complex, variegated, and difficult
to study than proteins or nucleic acids.”
<
|