|
|
Darwin természettudományos kutatásainak
és evolúcióelméletének jelentősége
Charles Darwin (1809–1882) 1825-ben kezdte el tanulmányait
Edinburghban, de apja kívánságával szembefordulva nem orvosnak
készült, hanem a tengeri gerinctelenekkel kezdett el foglalkozni, majd
természettudományi tanulmányait 1827–1831 között Cambridgeben
folytatta. Ebben az időszakban a legfejlettebb tudományágnak a
geológia számított, de a kőzetek tanulmányozása az ősi állatok
kövületeinek feltárásával jelentősen elősegítette a morfológia és a
rendszertan fejlődését is. Közvetlenül tanulmányai
befejezése után a család anyagi támogatásával lehetősége volt
csatlakozni egy világkörüli tengeri expedícióhoz. Az Angliából induló
HMS Beagle elnevezésű vitorlás hajó Chile és Argentína partjai
mentén és a Galapagos szigetek körül hajózva kezdte meg útját, majd
Ausztrálián keresztül tért vissza a szigetországba (1.
kép). Darwint továbbra is elsősorban a tengeri
gerinctelenek élete érdekelte, de az utazás során figyelme a
szárazföldi és a szigeteken élő poszáták, pintyek és egyéb fajok
sokfélesége felé fordult. Aprólékos és alapos megfigyelései alapján
jutott arra a következtetésre, hogy a szárazföldtől több ezer
mérföldre fekvő kis szigeteken élő madarak ugyan nagyon hasonlítanak
egymásra és a kontinensen élő társaikra, de a különböző szigeteken élő
madarak eltérő típusú táplálék szerzésére alkalmas csőrrel
rendelkeznek. Az ötéves hajóút során Darwin kézzel írott és rajzokkal
kiegészített jegyzeteiben nagy részletességgel dokumentálta
megfigyeléseit, számos új és különleges fajt írt le és hazatérése után
hosszan tartó rendszerező munkával dolgozta ki és támasztotta alá a
fajok fejlődéséről alkotott elméletét. Ezt mi sem bizonyítja jobban,
mint hogy Darwint csak kortársa, Alfred Russel Wallace nagyon hasonló
evolúciós elképzeléseinek megismerése késztette arra, hogy saját
elméletét nyilvánosságra hozza. Wallace levélben kereste meg Darwint,
aki barátai tanácsára a Linné Társaság külön ülésén – Wallace
eredményeit is bemutatva – számolt be először a fajok eredetével
kapcsolatos tanulmányairól, amit a Fajok keletkezése címmel csak
ezután, 1859-ben jelentetett meg. Anglia viktoriánus társadalmában a
fejlődés gondolata ugyan elfogadható volt, de Darwin evolúciós
elmélete mégis komoly visszhangot váltott ki, és a könyv kiadása
legalább annyi ellenséges véleményt, mint lelkes hívet toborzott a
szerzőnek. Bár Gregor Mendel éppen ebben az időszakban kezdte el
genetikai vizsgálatait, Darwinnak a természet tér- és időbeli
sokféleségével kapcsolatos felfedezéseinek nagyszerűsége éppen abban
rejlik, hogy a gének és az öröklődés mechanizmusának ismerete nélkül,
kizárólag morfológiai megfigyelések alapján jutott el az
evolúcióelmélet megfogalmazásához, ami mára a genetikai ismeretek
birtokában és módszertani eszköztárának alkalmazásával bizonyíthatóvá
vált, és így a természettudományos gondolkodás szerves részévé lett.
A föld élővilágának összetétele
Az élő szervezetek mai tudásunk szerint három fő csoportba sorolhatók:
a sejtmag nélküli prokarióták, az archea fajok, melyek nem
rendelkeznek sejtmaggal, de genetikai állományuk közel áll a
sejtmaggal rendelkező szervezetekhez, az eukariótákhoz. A
laboratóriumban nem tenyészthető baktériumokról és archeákról még ma
is csak keveset tudunk, noha egyes típusaik – mint például a bélben
velünk együtt élő mikroorganizmusok – fontos szerepet játszanak az
emésztőrendszer egészséges működésében. Ezzel ellentétben a fertőző
betegségek kiváltásáért felelős mikroorganizmusok más szervezetekbe
behatolva azok működését és sokszor életét is veszélyeztetik. Mivel a
teljes biomassza mintegy 90%-át mikroorganizmusok teszik ki, a földi
élet a jórészt még ismeretlen mikrobák környezetében folyik.
Sokféleségükkel, gyors szaporodási képességükkel és ennek köszönhető
nagyfokú alkalmazkodó képességükkel ezek a szervezetek jelentős
túlélési előnyt élveznek a magasabb rendű szervezetekkel szemben.
Ennek látványos példája a tüdőbajt okozó mikobaktérium típus gyors
evolúciója az antibiotikumok bevezetésétől napjainkig. Bár ez az új
gyógyszer a múlt évszázad közepétől kezdődően számos ember életét
mentette meg, az antibiotikumok elterjedt alkalmazása olyan erős
szelekciós nyomást jelentett, hogy azok a mutáns baktériumok, amelyek
ellenállónak bizonyultak az újabb és újabb szerekkel szemben, jelentős
túlélési és szaporodási előnyre tettek szert. Ennek következtében
napjainkra a tuberkulózis újra gyógyíthatatlan betegséggé vált, és
gyors terjedése világjárvánnyal fenyeget. A környezeti hatások által
kiváltott, napjainkban zajló evolúciós folyamatokkal kapcsolatban
számos egyéb példát is lehetne említeni, igazolva a földrajzi határok
megszűnése, a környezetszennyezés és a klímaváltozás által okozott,
sokszor nem várt hatások következményeit.
Evolúciós sikertörténet a változatlanság:
a gerinctelenek immunrendszerének evolúciója
A környezetben előforduló mikroorganizmusok – bár ezek nem mind
kórokozók – állandó veszélyt jelentenek a többsejtű élőlényekre. Ennek
oka, hogy ha a védekezőrendszerek működésében hiányosság lép fel, a
mikrobák néhány óra leforgása alatt ellephetik a többsejtűeket. A
gerinctelenek kizárólag természetes immunitással rendelkeznek,
amelynek molekuláris elemei a mikroorganizmusok olyan szerkezeti
egységeit ismerik fel, kötik meg, vagy bontják el, melyek az evolúció
során keveset változtak. Így, ahogyan a mikroorganizmusok szerkezeti
elemei megőrizték ősi jellegüket, úgy a természetes védekezési
rendszernek a működési elve, stratégiái sem változtak jelentősen.
Többsejtű állatokban a veleszületett immunitás első védelmi vonalként
működik, ennek a rendszernek a sejtjei és molekulái találkoznak
először a betolakodókkal, dolgozzák fel, és jelzik a veszélyt, aminek
alapján a szervezet a megfelelő védelmi reakcióval reagál.
Gerincesekben az adaptív immunitás elemei a veleszületett immunitás
rendszerére épülve és azzal együttműködve tudnak csak hatékonyan
működni, hiányában életképtelenek lennénk. Ezzel szemben az állatvilág
90%-át kitevő gerinctelen élőlényekben a veleszületett immunitás
megléte elegendő a sikeres túléléshez, és nincs szükség az adaptív
immunitás mechanizmusaira.
A természetes és adaptív immunitás
által közvetített védelmi folyamatokat egyaránt a felismerés, a
jelátvitel és a válaszreakciók szakaszára osztjuk. A veleszületett
immunitás általi felismerés fő jellemzője, hogy a felismerésben részt
vevő receptorok a mikroorganizmusok olyan, a nagy rendszertani
kategóriáira jellemző közös molekuláris mintázatok felismerésére
szakosodtak, melyek nélkülözhetetlenek az adott mikroorganizmus
életfolyamataihoz. Ilyen molekulák például a baktériumok sejtfalát
alkotó ismétlődő cukormintázatok, amelyek létfontosságúak a
baktériumok számára, ugyanakkor nincsenek jelen a többsejtű
szervezetekben, és szerkezetük a törzsfejlődés során nem változott
(2. ábra). Ez
a látszólag egyszerű elven működő rendszer rendkívül hatékony, aminek
során az immunsejtek receptoraik segítségével felismerik, bekebelezik
vagy körülhatárolják az idegen testeket, a vérben keringő oldott
komponensek pedig antimikrobiális hatásuk révén semlegesítik a
behatoló mikroorganizmusokat. Ezek a védekezési és hatástalanító
stratégiák szintén egységes rendszerként őrződtek meg, és maradtak
fenn a törzsfejlődés során.
A végrehajtó funkcióval rendelkező
válaszreakciók alapján sejt közvetítette és humorális folyamatok
különíthetők el. A sejtközvetítette folyamatok közé soroljuk a
bekebelezés (fagocitózis) és a tokképzés folyamatát. A bekebelezés
(3a. ábra) az
egyik legősibb folyamat, mely eredetileg csupán a táplálkozást
szolgálta. Szivacsokban az ekto- és endoderma közötti amőbaszerű
sejtek a táplálék szállításán kívül már részt vesznek a védekezési
folyamatokban is. Ehhez hasonlóan a planária esetében a retikuláris
sejtek baktériumokat is képesek bekebelezni, és a valódi testüreggel
rendelkező gerinctelen állatok vérében a fagocita sejtek folytonos
őrjáratot végeznek. A szervezetbe kerülő nagyméretű idegen
részecskéket, például élősködőket vagy a megváltozott saját szöveteket
a védekező rendszer a vérsejtek révén tokképzéssel hatástalanítja.
Hasonló funkciót lát el gerincesekben a tályogképződés, vagyis a káros
behatoló elszigetelése. Gerinctelenekben ezt a jelenséget a XIX.
század végén Ilja Mecsnyikov írta le először. Kísérleteiben
rózsatövist szúrt a tengeri csillag átlátszó lárvájába, majd azt
figyelte meg, hogy a vérsejtek körülveszik és beburkolják az idegen
testet. Hasonló jelenség játszódik le akkor is, amikor a parazitoid
darázs petéket rak az ecetmuslica lárvájának testüregébe. A behatolást
követően az idegen részecskék hatására képződő speciális lemezes
immunsejtek, a lamellociták más sejtekkel együtt körülveszik, és több
rétegben beburkolják a betolakodót (3b.
ábra). Az így képződött tokban a melanizációs
kaszkádfolyamat révén toxikus hatású szabad gyökök képződnek, s ezek
elpusztítják a petéket. A sejt közvetítette immunfolyamatok rendkívül
sikeres védekezési stratégiának bizonyultak, hiszen elsődleges, a
védelmi vonalban betöltött funkciójuk a törzsfejlődés során mindmáig
fennmaradt, noha a magasabb rendű szervezetekben a részt vevő sejtek
rendkívüli működésbeli változatosságot mutatnak.
Az oldott molekulák által közvetített humorális
immunreakciók során a vérben található molekulák kötődnek az idegen
természetű betolakodókhoz. Ezek részben hatástalanítják, részben
kaszkádszerű jelátviteli folyamatok révén új végrehajtó molekulák
termelődését váltják ki. Gerinctelenekben a hatástalanítás történhet
antimikrobiális peptidek, a véralvadási és komplementrendszer
működésére jellemző enzimkaszkádok, vagy elszíneződéssel járó
melanizációs reakciók révén. Míg az elsőként rovarokban azonosított
antimikrobiális peptidek és a komplementszerű reakciók megőrződtek a
törzsfejlődés során, addig a véralvadási és melanizációs reakciók csak
a nyílt keringésű gerinctelenekre jellemezőek. Az antimikrobiális
peptidek a baktériumok sejtfalába ékelődve pórust képeznek, és
megbontva a sejt ionegyensúlyát a mikroorganizmus pusztulását okozzák.
Jelen vannak a külvilággal folyamatos kapcsolatban lévő felszíni
hámokban, így például a rovarok légzőszervében, a gerincesek tüdő- és
a bél nyálkahártyájában. A rovarok testüregébe jutó mikroorganizmusok
hatására a vérsejtek és a zsírtest nagy mennyiségű antimikrobiális
peptid termelésére válnak képessé. Gyűrűsférgekben olyan
membránkárosító molekulákat azonosítottak, amelyek olyan membránokhoz
kötődnek, melyek a gazdaszervezetben nem fordulnak elő, így a saját és
nemsaját elkülönítése és hatástalanítása is megvalósul. E peptidek
lényeges sajátsága, hogy a baktériumokra hatásos koncentrációban még
nem mérgezőek a gazdaszervezetre, továbbá a termelődésükért felelős
molekuláris jelátviteli utak rendkívül konzerváltak, és így ez a
sikeres védekezési mód a hidrától az emberig valamennyi vizsgált
élőlényben fennmaradt.
A komplementszerű reakciók során – hasonlóan a
gerinces szervezetekhez – a hemolimfában lévő molekulák kötődnek a
mikroorganizmusokhoz, elősegítve ezek ártalmatlanítását.
Komplement-szerű reakciókat vagy molekulákat az atlanti tőrfarkú
rákban, a szúnyogban és a zsákállatban is leírtak (Iwanaga – Lee,
2005). A humorális védekezési reakciók egyik jellemző folyamata a
mikroorganizmusok által kiváltott véralvadási reakció, ami a tőrfarkú
rák hemolimfájában nagyon kis mennyiségű baktérium hatására már
gélszerűvé alvad, meggátolva a baktériumok további szaporodását. A
folyamatban szerepet játszó molekulák a baktériumok konzervált
sejtfalalkotóit, a lipopoliszacharidot ismerik fel, és így aktiválják
a véralvadási rendszert. A rovarokra, zsákállatokra, puhatestűekre,
tüskésbőrűekre jellemző, szintén a hemolimfában lezajló kaszkád során
fenoloxidáz aktiválódik, és a többlépéses folyamat végeredményeként
melanin (3b. ábra)
és reaktív oxigéngyökök képződnek, melyek elpusztítják a
betolakodót (Iwanaga – Lee, 2005). Ahhoz, hogy a folyamat ne terjedjen
ki az egész szervezetre, a reakciót speciális molekulák, a szerpinek
gátolják. A fenti példák alapján megállapítható, hogy bár a
felismerés–jelátvitel–válaszreakció folyamatai a különböző gerinctelen
szervezetekben kismértékben eltérő stratégiákra épülnek, a molekuláris
mintázatok felismerésén alapuló elv, a jelátviteli
rendszerek analóg elemei és a válaszreakciók típusai minden fajban
megmaradtak, alkalmazkodva az eltérő élőhelyekhez és az ezzel
kapcsolatos veszélyekhez.
A gerinctelen állatokban az immunrendszer sejtes és
humorális elemei – hasonlóan a gerincesekhez – elhatárolt szöveti
képződményekbe rendeződnek. A korszerű molekuláris genetikai eszközök
lehetővé tették, hogy gerinctelen állatokban, így például az
ecetmuslicában in vivo azonosítsuk és tanulmányozzuk ezek szerkezetét
és funkcióit (4. ábra),
illetve az immunválasz lezajlását. Hasonlóan a gerincesekhez, ezek
olyan szöveti képletek (vérképző szövet, keringés), amelyek külön
funkcionális egységeket alkotnak, a vérsejtek képződési helyeként
szolgálnak, és innen indulnak el az immunfolyamatok is (Andó et al.,
2004; Márkus et al., 2009). Feltételezhető, hogy kialakulásuk is
hasonló rendezőelvek alapján történik, így a bennük zajló folyamatok
megismerése az antimikrobiális peptidek szerepéhez hasonlóan általános
érvényű felismerésekhez vezethet.
A saját és idegen felismerés jelentősége
A törzsfejlődés folyamán az immunrendszer kialakulását több tényező is
befolyásolta. A szelekciós nyomást nem kizárólag a mikroorganizmusok
és paraziták jelentették, de szükségessé vált az is, hogy egy adott
faj egyedei különbséget tudjanak tenni a saját és a nem saját
molekulák között, illetve el tudják különíteni a megváltozott,
funkciójukat vesztett, esetleg fertőzött saját sejteket is. Ez a
képesség valószínűleg már a többsejtűek megjelenése során kialakult,
ugyanis a jelenséget már a több, egymással talpszerű struktúra révén
összekapcsolódó egyedekből álló telepes hidra estében is megfigyelték
(Lakkis et al., 2008). Ha különböző hidratelepek találkoznak, először
a talpszerű struktúrák érnek össze, de a találkozásnak három
lehetséges kimenetele is lehet: a „békés fúzió”, az „agresszív
elutasítás” vagy a „passzív kilökődés”. A jelenség szabályozásáért két
gén tehető felelőssé, melyek alléljainak kombinációja dönti el a
folyamat kimenetelét.
A saját és idegen felismerésének képessége minden
élő szervezet számára fontos. A baktériumok, gombák és növények saját
felismerő rendszerekkel rendelkeznek, melyek elsődleges szerepe a
genetikailag hasonló egyedekkel való párosodás megakadályozása és a
fajon belüli sokféleség fenntartása. Gerinctelenekben az
idegenfelismerés elsődlegesen immunológiai szerepet tölt be, de fontos
a megtermékenyítés során is. A nem szexuális úton szaporodó
baktériumoknál a genetikai sokféleséget a horizontális génátvitel
biztosítja.
Gerinces szervezetekben ezt a funkciót a
szövetösszeférhetőséget szabályozó géneket magában foglaló komplex, a
fő hisztokompatibilitási génkomplex (MHC) által kódolt fehérjék töltik
be. Bár a gének száma és elrendeződése a fajok között eltérő, közös
működési elvük, hogy a párválasztás és megtermékenyítés során a
különbözőséget, míg egyéb funkcióik során – mint például az
immunsejtek együttműködése – a hasonlóságot tekintik elfogadhatónak.
Az emberi genom legváltozatosabb génjei az MHC-komplexben elhelyezkedő
tizennyolc klasszikus MHC-gén, melyek egyedi sajátsága a génváltozatok
(allélok) nagy száma (Petrányi – Gyódi., 2005). Ennek eredményeként
egy adott gén a populáció egyedeiben eltérő variánsok formájában
fejeződik ki. Ezek között olyan ősi gének is találhatók, amelyek
közelebbi rokonságot mutatnak a mintegy félmillió évvel ezelőtt elvált
csimpánzok bizonyos alléljaival, mint egy másik emberi
MHC-génváltozattal.
Evolúcióbiológiai szemszögből a legérdekesebb
kérdés, hogy a sokféle MHC-gén kialakulását és megtartását a
populációban milyen hatások irányították. A legtöbb magyarázat olyan
természetes szelekciót valószínűsít, aminek eredményeként nem csupán
egy, hanem több változat is előnyös sajátságokat biztosít az egyed
számára. Az MHC-gének fontos szerepet játszanak a saját és nemsaját
felismerésben és a kórokozók elleni sejtes (T-sejt közvetített)
adaptív immunválasz kiváltásában. Így az MHC-gének sokféleségének
kialakulásában a kórokozókkal való folyamatos együttélés hatására
bekövetkező szelekciós nyomás szerepét is feltétlenül figyelembe kell
venni. Ez lehetővé teszi a legritkábban előforduló változatok pozitív
kiválasztódását, miközben újabb kihívást jelent az adott kórokozó
számára. Kellő populációméret esetén ez a mechanizmus biztosítja azt
is, hogy az evolúció eredményeként kialakult sokféleség fennmarad az
adott populációban, miközben a gének maximális száma nem változik.
Az emberi faj kialakulásának történetét a közel
teljes kihalással fenyegető egyedszámcsökkenések sorozata jellemzi.
Ennek eredményeként a jelenleg közel hétmilliárd egyedet számláló
emberi populáció – más fajokhoz viszonyítva – lényegesen kisebb
genetikai sokféleséggel rendelkezik. Így például a kevés egyedet
számláló, Nyugat Afrikában élő csimpánzok egyedei közti genetikai
különbségek sokkal nagyobbak, mint a földön élő összes ember
közöttiek. Ez a humángenom-vizsgálatok alapján arra enged
következtetni, hogy az elmúlt egymillió évre visszatekintve az emberi
populáció mérete, azaz a szülőképes nők száma átlagosan nem haladta
meg a 10 ezer főt. Az anyai ágon öröklődő DNS analízise alapján a ma
élő emberek közös őse a mintegy 130 ezer évvel ezelőtt,
Észak-Afrikában élő kis embercsoport egyedeire vezethető vissza. Ezt
követően további, legalább három olyan időszak azonosítható, amikor
természeti katasztrófák, mint például az Észak-Szumátrai Toba vulkán
szuperkitörése, vagy jegesedés és klímaváltozás hatására az emberi
populáció mérete mindössze ötezerre csökkent.
Régi mechanizmusok, új funkciók –
A fagocitózis evolúciója
A veleszületett immunitás hasonló elven működő folyamatainak
fennmaradása a fejlett gerinctelenektől egészen az emberig a jól
működő mechanizmusok megőrzését példázzák az evolúció során. Ezzel
éles ellentétben áll az adaptív immunrendszer kialakulása, amely az
alacsonyabbrendű gerincesekben szinte a „semmiből” az előző
immunfolyamatoktól elvileg eltérő új védelmi mechanizmust hozott
létre. Az alábbiakban egy, a törzsfejlődés által kiaknázott harmadik
lehetőségre, a korábban már létező mechanizmusok új funkciókra történő
alkalmazására mutatunk példát a fagocitózis evolúciójának
bemutatásával.
|
|
|
Már az egysejtű szervezetek szintjén is felmerült
az igény, hogy a sejt működéséhez szükséges tápanyagokat ne csak a
környező híg folyadékfázisból, hanem szilárd anyag formájában, például
baktériumok, moszatok révén – egyfajta ragadozó tevékenység során –
vegye fel a sejt. Ennek nyilvánvaló előnye a sokkal „táplálóbb”
anyagok felvétele, ugyanakkor a szilárd (bár mikroszkopikus) táplálék
felvétele és megemésztése teljesen új mechanizmusok kialakulását tette
szükségessé. Ennek megfelelően, már a fejlett egysejtűekben kialakult
a szilárd táplálék bekebelezésének és lebontásának folyamata, a
fagocitózis. Mint a táplálékfelvétel legfontosabb mechanizmusa, ez a
képesség az egysejtű világban „csúcsragadozói” státust eredményezett.
Fagocitózissal táplálkoznak az amőbák, mint például az egysejtű és
többsejtű állapotok között változó életciklust folytató, az állati
egysejtűekre és a nyálkagombákra is jellemző tulajdonságokkal
rendelkező élőlény, a sejtes nyálkapenész (Dictyostelium
discoideum), a fagocitózis laboratóriumi vizsgálatának egyik
közkedvelt alanya (5. ábra). Bár az amőbák és más egysejtűek
elsősorban baktériumokat és élesztőgombákat kebeleznek be és
pusztítanak el, a fagocitózisnak ezekben az élőlényekben kizárólag
táplálkozási, nem pedig immunológiai szerepe van, hiszen a táplálékul
szolgáló egysejtűek nem jelentenek veszélyt a fagocitáló sejtre.
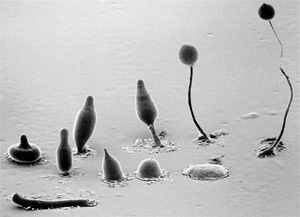
5. ábra • A sejtes nyálkapenész
(Dictyostelium discoideum) életciklusának állomásai
Az egysejtűekkel és gerinctelenekkel szemben a
magasabb rendű élőlényekben, köztük a gerincesekben, a táplálkozásnak
sokkal fejlettebb mechanizmusai is kialakultak. A tápanyagokban
gazdag, szilárd táplálék felvételére és továbbítására külön mechanikai
szervrendszer (száj–nyelőcső–gyomor–bél) jött létre. Ehhez szorosan
kapcsolódva kialakultak a táplálék emésztését végző enzimeket termelő
mirigyek, melyek termékeiket szabályozott módon ürítik a
bélcsatornába, és az állandó belső környezetet és a tápanyagok
szervezeten belüli továbbítását biztosító vérkeringési rendszer is.
Így a bélcsatornában megemésztett táplálékból származó tápanyagok a
bélcsatorna falán át a vérbe, majd a transzportrendszerek segítségével
az egyes sejtekbe jutnak el. Így sokkal hatékonyabb biológiai rendszer
alakult ki, és a fagocitózisnak mint fő táplálékfelvételi
mechanizmusnak a jelentősége a fejlett többsejtűekben lényegében
megszűnt.
A többsejtű szervezetekre jellemző sejtek közti
„munkamegosztás” során ugyanakkor a táplálékfelvételi és -továbbítási
rendszerrel párhuzamosan további új, specializálódott szervrendszerek
is létrejöttek. Ezek egyike maga a vér, amely a tápanyagok továbbítása
mellett az anyagcseretermékek eltávolításáért, a vérgázok (O2,
CO2) szállításáért és az állandó belső környezet
megteremtéséért is felelős. Kialakult a vérgázok kicserélését végző
tüdő, a központi szabályozást végző agy, a helyváltoztatást lehetővé
tevő izmok és a szervezet szerkezeti alapját biztosító csontrendszer.
E szervek és funkciók megjelenése a soksejtű szervezetek evolúciója
során újabb igényeket támasztottak, mint például a belső környezetnek
a külső kórokozóktól való védelme vagy a csontok megfelelő állapotának
(„kondíciójának”) fenntartása.
Míg tehát a fagocitózis mint táplálkozási forma
szerepe megszűnt, a soksejtű szervezetek kialakulása során számos új
funkció vált szükségessé. Az evolúció zsenialitását mutatja, hogy
utóbbiak közül egyesek kielégítésére a fagocitózis korábban kialakult
mechanizmusait vette igénybe a szervezet. A kórokozók elleni védekezés
egyik legfontosabb mechanizmusa a baktériumok és gombák fagocitózisa
lett, amit a fehérvérsejtek különböző specializált falósejtjei, köztük
a vérben nagy számban keringő neutrofil granulociták végeznek. Mert mi
is tudná jobban elpusztítani a kórokozókat, mint ez az evolúciós
léptékben is ősi mechanizmus, amely egysejtűekben a környező
baktériumok és gombák bekebelezésére és megemésztésére alakult ki? De
az evolúció ennél is tovább ment, és ugyanezt a mechanizmust használta
fel a csontszerkezet állandó átalakulásához szükséges csontlebontáshoz
is. A szervezet specializált fagocita sejtjei, az ún. oszteoklasztok
(csontfaló sejtek) az egysejtű amőbákban megfigyelhető fagocitózishoz
nagyon hasonló mechanizmussal veszik fel és emésztik meg az
elöregedett csontállomány darabkáit, ily módon helyet biztosítva az
új, mechanikailag erősebb csontállomány kialakulásának.
A fagocita sejtek tevékenysége így
elengedhetetlenné vált a többsejtű szervezetek működéséhez. Az
immunrendszer fagocita sejtjeinek, például a neutrofil granulociták
működési zavara súlyos, gyakran halálos bakteriális fertőzésekhez
vezet. Ennek egyik klasszikus formája az úgynevezett krónikus
granulomatózis, egy X-kromoszómához kötött öröklésmenetet mutató
súlyos immunhiány-betegség. A csontfaló sejtek túlműködése a
csontritkulás egyik legfontosabb kóroki tényezője, míg ugyanezen
sejtek fejlődési vagy működési zavara az oszteopetrózisnak nevezett, a
csontállomány jelentős megnövekedésével járó öröklött
betegséget hozza létre.
A fentiek alapján a fagocita sejtek működésének megértése nemcsak
evolúcióbiológiai, de nagyon komoly orvosi jelentőséggel is bír. A
fagocita sejtek vizsgálata például fontos adatokkal szolgált a
krónikus granulomatózis megértéséhez és új terápiás lehetőségek
kidolgozásához. Fagocitózis-zavarban szenvedő egerekben az emberi
oszteopetrózishoz hasonló betegség figyelhető meg (6.
ábra), amely fontos állatmodellül szolgál az
oszteopetrózis, de akár a csontritkulás megértésének tanulmányozásához
is (Mócsai et al., 2004). A fentiek azonban rávilágítanak arra is,
hogy e folyamatokat nem kell feltétlenül emlősökben vizsgálni. Egy
svájci munkacsoport (Cosson et al., 2008) nagy erőkkel vizsgálja az
egysejtű Dictyostelium discoideum táplálkozását abban a reményben,
hogy megfigyeléseik a későbbiekben elősegítik majd a fertőző
betegségek és a csontanyagcserezavarok megértését és gyógyítását.
Immunológiai ősrobbanás:
az ellenanyagok evolúciója
Amint azt a korábbi fejezetekben tárgyaltuk, már a legősibb
szervezeteket is változatos mechanizmusok védik a környezetükben élő,
akár a szervezetükbe is behatoló organizmusok káros hatásaitól. A
veleszületett immunitás evolúciója során a fejlettebb fajok genomjában
rögzült azoknak a fehérjéknek a kódja, amelyekkel a kórokozókat
azonosítani képesek, és káros hatásaikat ki tudják védeni. E gének
rendkívül nagy állandóságot mutatnak, azaz a faj minden egyes
egyedében szinte azonos szekvenciával rendelkeznek. Működésük alapja
az a szelekciós nyomás eredményeként kialakult „tapasztalat”, amellyel
azonosítani képesek a kórokozókat, felismerve azok sajátos molekuláris
mintázatait. Ennek következtében e mechanizmus igen hatékonyan és
nagyon rövid idő alatt képes elpusztítani vagy más módon semlegesíteni
a kórokozók nagy hányadát. Ebben az evolúciós folyamatban azonban a
kórokozók is kialakították elhárító válaszreakcióikat, amelyekkel
elpusztításukat elkerülhetik.
A magasabb rendű állatok reprodukciós sajátosságai
alapvetően különböznek az alacsonyrendű kórokozókétól, hiszen
ritkábban és kisebb számban hoznak létre utódokat. Ezen kívül több
sejtből állnak, melyek szervekbe, szervrendszerekbe tömörülnek, és
ezek az eltérő funkciójú egységek összehangoltan működnek. Az
integrált működés alapfeltétele, hogy a sejtmegújulás során ne
változzon a genetikai kód, így az új sejt morfológiailag és
funkcionálisan is beleillik szöveti környezetébe. Ez alól csak azok a
sejtek jelentenek kivételt, amelyek pontosan szabályozott feltételek
mellett változnak a szervezet egyedfejlődését követve. A sejtosztódás
során szükséges pontos másolást a hibajavító enzimek biztosítják,
amelyek a DNS replikáció során esetenként bekövetkező mutációkat
folyamatosan korrigálják. Másik fontos sajátossága a magasabbrendű
fajok testi sejtjeinek, hogy osztódásuk korlátozott mértékben,
szabályozottan történik.
Ezzel ellentétben, a kórokozók általában önállóan
is életképesek (kivételt képeznek a többsejtű parazita férgek) és
rövid idő alatt igen nagymértékben képesek megsokszorozódni. Fontos
különbség, hogy számos kórokozó (főként a vírusok) nem kódol
hibajavító enzimeket, amelynek következtében osztódásuk nagyszámú
mutációval jár. Bár a mutációk túlnyomó többsége végzetes a patogén
számára, néhány esetben olyan új tulajdonság megjelenéséhez vezet,
amely a környezethez – így a megfertőzött szervezet immunrendszeréhez
– történő alkalmazkodását jelentősen megkönnyíti.
A magasabbrendű gazdaszervezet és az alacsonyrendű
kórokozó közötti kapcsolat mindkét szervezetet folyamatos változásra,
szelekción keresztül megvalósuló adaptációra készteti. Nyilvánvaló
azonban, hogy ez a több generáción átívelő folyamat a rövid
életciklussal és nagy reprodukciós potenciállal rendelkező kórokozók
esetében lényeges előnyt biztosít a megtámadott magasabbrendű
szervezettel szemben. Bár a magasabbrendű állatok szervezetében is
genetikai változás révén valósul meg a fertőzésnek ellenálló egyedek
szelekciója, ez a folyamat ebben az esetben sokkal
hosszabb időt vesz igénybe. Éppen ezért alakulhatott ki az egyedet
védő összetett immunválasz, sőt a gerincesekben az adaptív
immunrendszer egyes elemei az egyed védelme mellett, a faj védelmét,
illetve fennmaradását is biztosítják. Ennek hátterében az áll, hogy az
adaptív immunitást biztosító gének közül néhányra a nagyfokú genetikai
polimorfizmus jellemző, ami biztosítja, hogy a faj egyes egyedei
ellenállóbbak egy adott kórokozóval szemben, mint a többi. Erre kitűnő
példa a már ismertetett MHC-polimorfizmus jelensége. Ezt a dinamikus
koevolúciós kölcsönhatást vázolja a
7. ábra (Litman et al., 2005).
A behatoló kórokozók nagy többségét a veleszületett immunrendszer igen
gyorsan és hatékonyan eliminálja. Az életben maradó patogének, illetve
ezek újabb mutánsai azonban a fentiek alapján olyan új tulajdonságokra
tehetnek szert, amellyel elkerülik ezt a védelmet, és ez a
gazdaszervezet pusztulásához vezethet. Míg a gerinctelen állatok nagy
többségében ezzel egyensúlyt tart a viszonylag nagyszámú utód és a
rövid életciklus, addig a gerincesek esetében ezek a mechanizmusok nem
biztosítanak megfelelő védelmet, hiszen sokkal kevesebb utódot
nemzenek és általában hosszabb ideig tart a generációváltás. Ennek
eredményeképpen megjelent az immunrendszer második védelmi vonala, az
adaptív immunitás, amit többen immunológiai ősrobbanásnak is neveznek.
Ennek egyik legfontosabb alappillére egy olyan sejtfelszíni
receptorkészlet kialakulása, amely az idegen molekulák parányi
részleteinek pontos felismerését biztosítja. Ilyen különleges és
változatos felismerő receptorokkal csak a limfociták két csoportja, a
B- és T-sejtek rendelkeznek. E rendszer legfontosabb tulajdonsága,
hogy a természetes immunválasz által el nem pusztított és a
szervezetben folyamatosan változó kórokozókat egyfajta párhuzamos
„mikroevolúcióval” makacsul „üldözi”, mindaddig, míg teljesen ki nem
iktatja azokat. Ezt a folyamatot a szervezeten belül egyfajta
„macskaegér” harcként jellemezhetjük, amelynek során a kórokozóból
folyamatosan új változatok képződnek az immunválasz elkerülése
érdekében, míg az immunrendszer folyamatosan hoz létre olyan új
receptorokat és molekulákat, amelyekkel ezek az új mutánsok is
felismerhetők, és azonosításukat követően elpusztíthatók. Ez a fajta
immunitás – bár a behatolást követően lassabban alakul ki, sokkal
hatékonyabban véd, mint a természetes immunválasz. Az immunológia
történetének „hajnalán” az adaptív immunitás jelentőségét és működési
elvét először a B-limfocitákból fejlődő „fehérjeüzemek”, a
plazmasejtek által termelt ellenanyagok sokfélesége
és fajlagos működése kapcsán ismerték fel, majd az MHC-molekulák
közvetítésével működő T-limfociták receptorai esetében is igazolták
(Rajnavölgyi, 2003). A továbbiakban az ellenanyagok (immunglobulinok)
termelődésének és sokféleségük kialakulásának mechanizmusait és
hatását ismertetjük.
A XX. század egyik kimagasló tudományos
teljesítményeként sikerült tisztázni, hogy a magasabbrendűek
szervezetében milliárdos nagyságrendben jelen lévő, különböző
fajlagossággal rendelkező ellenanyag-molekulát olyan fehérjeláncok
(két nehéz és két könnyű) alkotják, amelyek több önálló gén-
„modulból” véletlen rekombinációval jönnek létre (Tonegava Susumu
[Susumu Tonegawa], 1983, Orvosi Nobel-díj 1987) (8.
ábra). A folyamat a csontvelőben zajlik, ahol a B-limfociták
érése során minden egyes sejt egyedi, egymástól eltérő sejtfelszíni
receptort fejez ki. Ezt követően azok a sejtek, amelyek képesek a
szervezet saját molekuláival kapcsolódni, elpusztulnak (így alakul ki
az ún. centrális tolerancia), míg a többi sejt a másodlagos
nyirokszervekbe (nyirokcsomó, lép, önálló nyiroktüszők) kerül. A
továbbiakban ezek a sejtek receptoraik fajlagosságának megfelelő
molekulával (antigén) kapcsolódhatnak, és amennyiben ehhez a jelhez
egy további megerősítő szignál csatlakozik, aktiválódnak. Ez a
megerősítő szignál rendkívül jelentős, és ezen a ponton ismét
megfigyelhetjük a veleszületett és az adaptív immunitás szerves
integrációját. Ahogy a korábbiakban ismertettük, a természetes
immunrendszer – benne a fagocitasejtek – sajátossága, hogy a
patogéneket meg tudja különböztetni a magasabbrendű szervezetek
molekuláris mintázataitól. Ha a makrofágok és a dendritikus sejtek
által felvett anyagok kórokozó sajátosságúak, akkor ezek az
antigén-prezentáló sejtek olyan megerősítő jeleket közvetítenek az
antigént megkötő B-limfociták felé, hogy azok ellenanyagtermelő
plazmasejtté alakulnak, és a korábban sejtfelszíni receptorként
szolgáló immunglobulint nagy mennyiségben oldott formában termelik.
Második jel hiányában azonban ez a folyamat nem, vagy csak kis
intenzitással valósul meg (perifériás tolerancia). A természetes és az
adaptív immunrendszer integrált működése megfigyelhető az opszonizáció
során is. Ilyenkor az adaptív immunválasz során keletkező
ellenanyagok befedik a patogént, melyeket lényegesen hatékonyabban
kebeleznek be a fagociták, mint a „csupasz” antigént.
Kiemelendő, hogy az adaptív immunrendszer
biztosítja azt, hogy bár előre nem ismert a szervezetet támadó
kórokozó típusa és molekuláris jellemzői, a szervezetben gyakorlatilag
minden patogénnel szemben találhatók specifikus receptorral rendelkező
limfociták. A fentiek magyarázzák azt is, hogy ez a rendszer a
szervezeten belül változó kórokozókat is képes felismerni és
semlegesíteni. Egészséges szervezetben mindez anélkül történik, hogy
az immunrendszer a szervezet saját struktúráit megtámadná.
Bár az ellenanyagokat régóta használják gyógyításra
(például kígyóméreg semlegesítésére), sőt a bélflóra specifikus
szabályozására is fejlesztik azokat (Kacskovics, 2003), a monoklonális
ellenanyag-technológia felfedezésével (Orvosi Nobel díj 1984: Niels K.
Jerne, Georges J. F. Köhler és César Milstein) olyan eszköz került
birtokunkba, amellyel a legkülönfélébb terápiás célpontok ellen lehet
jól jellemzett felismerő molekulát létrehozni és a szervezeten belül
célba juttatni. Ezek a molekulák önmagukban vagy bizonyos toxinnal
kombinálva (ez utóbbit a szintén Nobel-díjas Paul Ehrlich „mágikus
lövedéknek” nevezte el) képesek például tumorsejtekhez kötődni, és
azokat elpusztítani. Más típusú ellenanyagokat például különböző
autoimmun betegségek kezelése során is alkalmaznak (például TNFα
receptor blokkolók). Napjainkban mintegy húsz monoklonális
ellenanyagot használnak gyógyítási célra, és számuk néhány éven belül
várhatóan 150-200-ra emelkedik (Carter, 2006).
Kulcsszavak: evolúció, természetes és szerzett immunitás, saját és
idegen felismerés, fagocitózis, ellenanyag-termelés
IRODALOM
Andó István – Laurinyecz B. – Márkus R. et
al. (2004): Ősi örökségünk, a veleszületett immunitás: a Drosophila
immunrendszere. Magyar Tudomány. 10, 1080–1108.
Carter, Paul J. (2006): Potent Antibody
Therapeutics by Design. Nature Reviews Immunology. 6, 343–357.
Cosson Pierre – Soldati Thierry (2008):
Eat, Kill Or Die: When Amoeba Meets Bacteria. Current Opinion in
Microbiology. 11, 271–276.
Iwanaga, Sadaaki – Lee, Bok-Leul (2005):
Recent Advances in the Innate Immunity of Invertebrate Animals.
Journal of Biochemistry and Molecular Biology. 38, 128–150.
Janeway, Jr. Charles A. – Travers, P. –
Walport, M. – Shlomchik, M. J. (2001): Immunobiology: The Immune
System in Health and Disease. 5th ed. Garland Publishing, New York,
NY.
Kacskovics Imre (2003): A tehéntej
immunglobulinja – a jövő precíziós fegyvere a bélfertőzések ellen.
Magyar Tudomány. 4, 461–469.
Lakkis, Fadi G. – Dellaporta, S. L. –
Buss, L. W. (2008): Allorecognition and Chimerism in an Invertebrate
Model Organism. Organogenesis. 4, 4, 236–240.
Litman, Gary W. – Cannon, J. P. – Dishaw,
L. J. (2005): Reconstructing Immune Phylogeny: New Perspectives.
Nature Reviews Immunology. 5, 866–879.
Márkus Róbert – Laurinyecz B. – Kurucz É.
et al. (2009): Sessile Hemocytes As a Hematopoietic Compartment in
Drosophila melanogaster. Proceedings of the National Academy of
Sciences of the USA. 106, 4805–4809.
Mócsai Attila – Humphrey M. B. – Van
Ziffle J. A. et al. (2004): The Immunomodulatory Adapter Proteins
DAP12 and Fc Receptor γ-chain (FcRγ) Regulate Development of
Functional Osteoclasts through the Syk Tyrosine Kinase. Proceedings of
the National Academy of Sciences of the USA. 101, 6158–6163.
Petrányi Győző – Gyódi Éva (2005): A fő
hisztokompatibilitási rendszer (MHC) molekuláris genetikai szerepe a
„saját és idegen” felismerésben és jelentősége a fajfejlődésben.
Magyar Tudomány. 6, 659 -670.
Rajnavölgyi Éva (2003) A dendritikus
sejtek és terápiás fel-használási lehetőségeik. Magyar Tudomány. 4,
440–450.
Tonegawa, Susumu (1983): Somatic
Generation of Antibody Diversity. Nature. 302, 575–581.
LÁBJEGYZETEK
1 Készült a Magyar
Tudományos Akadémia Biológiai Osztály Immunológiai Bizottsága és a
Magyar Immunológiai Társa-ság által szervezett, 2009. április 24-én,
az Immunológia Napja rendezvényen elhangzott előadások alapján.
<
|
|