|
Az eljárás azon alapul, hogy különböző
hőmérsékleteken a fenti reakció egyensúlya különböző irányba tolódik
el. Alacsony hőmérsékleten a kénhidrogénből megy át több deutérium a
vízbe, a víz feldúsul deutériumban. Magas hőmérsékleten pedig éppen
fordítva: a vízből megy át több deutérium a kénhidrogén gázba.
Az ipari megvalósításban kénhidrogén gázt
keringetnek két különböző (30 °C, illetve 130 °C) hőmérsékletű térrész
között. A kénhidrogén felveszi a deutériumatomokat a magasabb
hőmérsékletű vízből, és leadja az alacsonyabb hőmérsékletűnek, tehát
tulajdonképpen a deutérium „hordozója”. Megfelelő kaszkád-kapcsolással
elérhető, hogy néhány ilyen fokozattal a deutérium aránya jelentősen
(15–20%) feldúsuljon. További – például atomreaktorbeli –
alkalmazáshoz elegendő dúsítású nehézvizet ebből már vákuumos
desztillációval, illetve elektrolízissel állítanak elő. A
GS-eljárásban szereplő nagy mennyiségű kénhidrogéngáz komoly
környezeti kockázatot jelent.
Nehézvízgyártás világszerte
Nagyobb mennyiségű előállítása a nukleáris láncreakció felfedezése és
az atomfegyverkezési verseny kapcsán kezdődött el. 1934-ben a Norsk
Hydro építette az első nehézvíz-előállító üzemet Vermorkban
(Norvégia), egy vízerőmű villamos energiáját használva. Az üzem
kezdeti kapacitása mindössze 20 liter volt évente, de a németek
Norvégia megszállása (1940. április) után a kapacitást megemelték egy
tonna/évre. 1942 végén a nehézvízüzem elleni brit támadás még
meghiúsult, ám 1943. február 27-én a szövetségesek norvég partizánok
segítségével sikeres támadást hajtottak végre, súlyos csapást mérve a
német nehézvíz-utánpótlásra.
A kanadai Trailben 1943-ban helyeztek üzembe egy
nehézvízgyárat, amely az amerikai Manhattan-programhoz szükséges
nehézvizet állította elő a róla elnevezett eljárással. Kanada máig a
világ egyik legnagyobb nehézvíz-előállítója, mivel a kanadai CANDU
(Canada Deuterium Uranium)-atomreaktorok nehézvizet használnak
moderátorként. Az 1979-ben üzembe helyezett Bruce (Douglas Point,
Ontario) Nehézvízgyár volt a világ legnagyobb ilyen létesítménye. A
GS-eljárást használta, amellyel 700 tonna nehézvizet állított elő
évente. Egy tonna nehézvíz előállításához 340 000 tonna tápvizet
kellett elhasználni. A Bruce-nehézvízüzem telephelyén nyolc
CANDU-reaktor működött, amelyek a nehézvíz előállításához szükséges
ipari hőt és villamos energiát szolgáltatták. A csernobili baleset
hatására a kilencvenes években lecsökkent az atomerőművek iránti
kereslet, és lényegesen megjavították az atomerőművi nehézvíz
visszanyerési technológiáját is. Ezek miatt világszerte nagyon
lecsökkent a nehézvízigény, a Bruce-üzem termelése feleslegessé vált,
így az üzemet 1997-ben leállították, és leszerelték.
Nehézvizet a világon még sokfelé állítanak elő, például Argentínában,
Indiában, Iránban és Romániában is. Feltehetően az atomhatalmak
mindegyike állít elő nehézvizet is.
Néhány alkalmazás
Izotópos nyomjelzés • Nem sokkal a felfedezése és előállítása után,
1934-ben Hevesy György már izotópos nyomjelző gyanánt használta a
nehézvizet, a víz emberi testben való körforgásának vizsgálatára. A
nehézvíz nyomjelzőként való alkalmazása azóta széles körben elterjedt.
Mivel a hidrogén nagyon sok szerves molekula alkotóeleme, a
deutériummal való nyomjelzés sok molekula metabolizmusának
vizsgálatában fontos szerepet játszik. Ilyen alkalmazás a „kettősen
nyomjelzett víz” (doubly labeled water) nevű eljárás, amelynek az a
lényege, hogy a vizsgált szervezetnek beadott vízmintában nemcsak a
könnyűhidrogént cserélik ki deutériumatomokra – részben vagy teljesen
–, hanem az oxigénatomot is 18O-ra. Ezt követően bizonyos idő
elteltével vizsgálják a szervezetből kiürült vízben (vizelet,
izzadság) a nyomjelző atomok arányát. A szervezet energiamérlegében
nagy szerepe van az oxigén metabolizmusának. Mivel az oxigén a
szervezetből vízhez kötve, illetve CO2 formájában is
távozhat, az energia-háztartáshoz pedig csak a CO2
formájában történő kibocsátásnak van köze, fontos lenne a két távozási
út kvantitatív szétválasztása. Erre ad lehetőséget a kettősen
nyomjelzett víz. A hidrogén csak vízhez kötve távozik, ezért a
kiürülés vizsgálatakor a távozó vízben a deutérium és az 18O
arányából meghatározható az, hogy a bevitt (jelzett) oxigén
hanyadrésze távozott CO2 formájában.
Neutronszórás • Neutronszórásos kísérletekben a
neutronok az atommagokon szóródnak, ezért a különböző izotópok –
eltérő magfizikai tulajdonságaik miatt – különbözőképpen lépnek
kölcsönhatásba a neutronokkal. Emiatt neutronszórásos kísérletekben –
elsősorban biológiai minták vizsgálatánál – fontos szerepet kap a
nehézvíz, illetve a hidrogénatomok deutériumatomokra való cserélése.
Különösen érdekes, hogy míg a deuteron szórási hossza +0,6671×10-12
cm, addig a protoné -0,3742×10-12 cm. Azaz a két
hidrogénizotóp szórási hossza ellenkező előjelű, ezért szórásuk nagyon
különböző. Ez komplex biológiai mintákban lehetővé teszi a különböző
komponensek szétválasztását a neutronszórás során. Ezt a technikát
kontrasztváltoztatásnak vagy kontrasztillesztésnek hívják. Az
oldószerben változtatjuk a nehézvíz (deutérium) koncentrációját, ennek
következtében az egyes biológiai komponensekben is lecserélődik a
protonok egy része deuteronokra. Ezáltal elérhető, hogy egyes
biológiai komponensektől eredő szórás egyezzen meg az oldószertől
eredő szórással, azaz az illető komponens kontrasztja „eltűnik”.
Például egy DNS-t, proteineket, lipideket tartalmazó biológiai
mintánál a fehérjék kontrasztja 40−45%-os nehézvíz-koncentrációjú
oldatban „tűnik el”. Ilyen oldószert alkalmazva csak a DNS és a
lipidek lesznek „láthatók”.
Magmágneses rezonancia (NMR) • Az NMR a
molekulaszerkezet-vizsgálat egyik fontos eszköze. Alapja az, hogy az
atommagok mágneses momentuma a külső mágneses térhez képest különböző
irányokba „állhat be”, s ez a mágneses térrel való kölcsönhatás miatt
különböző energiájú állapotokat jelent. A lehetséges állapotok számát
az atommag impulzusmomentuma határozza meg, az egyes állapotok közötti
energiakülönbséget pedig az atommag mágneses momentuma, kémiai
környezete és az alkalmazott mágneses tér. Ezen állapotok között
elektromágneses gerjesztéssel az energiakülönbségnek megfelelő –
általában rádiófrekvenciás – térrel átmeneteket lehet létrehozni. Ezek
segítségével nemcsak a molekulában lévő – NMR-jelet adó – atomok
számáról, hanem azok kémiai környezetéről is információ nyerhető. A
deuteron mind impulzusnyomatékában, mind mágneses momentumában
különbözik a protontól (lásd táblázat), ezért az NMR szempontjából
egészen másképpen viselkedik. Protonokra hangolt NMR-készülék számára
a deuteronok láthatatlanok.
| |
impulzus-momentum |
mágneses momentum |
| proton |
1/2 h |
1,410 606 633 (58)·10-26
J/T |
| deutérium |
1 h |
0,432 852 123 (67)·10-26
J/T |
Biológiai molekulákban lévő protonok helyzete NMR-rel általában
nehezen vizsgálható, mert az oldószerként használt vízben lévő
protonok NMR jele elnyomja a molekula protonjainak a jelét. Ilyen
esetekben az oldószer nehézvízre cserélése segít a vizsgálat
elvégzésében, amelynek során az is nyomon követhető, hogy a
molekulában lévő protonok milyen ütemben cserélődnek le az oldószerben
lévő deuteronokra.
Neutrínódetektor • A legnagyobb mennyiségű
nehézvizet az atomenergia-ipar használja (lásd a következő pontot).
Különösen kiemelkedik Kanada, ahol a hazai felhasználásra és
kereskedelmi forgalomra is gyártott CANDU-reaktorokban több tonna
nehézvíz végzi a neutronok lassítását és a reaktor hűtését. Az 1986-os
csernobili reaktorbaleset után az atomerőmű-építés világméretű
lendülete megtorpant – a nyugati államokban szinte teljesen leállt –,
és így a CANDU-reaktorokhoz már előállított és raktárakban
felhalmozott rengeteg nehézvízre megszűnt az atomenergia-ipar igénye.
A részecskefizikusok – kihasználva ezt az időszakot – a nehézvíz egy
részecskefizikai tudományos kísérletben való felhasználásával álltak
elő, amelyhez megszerezték a kanadaiak támogatását is.
A Napban – több részfolyamat során – négy proton
4He atommaggá fuzionál. A standard napmodell szerint ez a folyamat
szolgáltatja a Nap energiáját. E folyamatban neutrínók keletkeznek – a
különböző részfolyamatokban különböző energiával, illetve
energiaeloszlással. A neutrínók parányi, semleges részecskék, és csak
a gyenge kölcsönhatásban vesznek részt. A három leptoncsaládhoz
egy-egy neutrínó is tartozik, külön az elektronhoz, a müonhoz és a
tau-mezonhoz. A Napban elektron-neutrínók keletkeznek.
A standard napmodell elég jó becslést ad arra
vonatkozólag, hogy a Napból a Földre milyen fluxusú és
energiaeloszlású elektron-neutrínóknak kellene érkezniük. Már az
1960-évektől kezdve komoly fejtörést okozott az, hogy a Nap-neutrínók
észlelésére készült, s azóta is tökéletesített kísérletek jóval
kevesebb neutrínót detektáltak, mint amennyit a standard napmodell
jósolt.
A Nap-neutrínók rejtélyének egyik megoldását a
neutrínó-oszcilláció hipotézise kínálta, amely szerint a háromféle
neutrínó egymásba át tud alakulni. E modell szerint mire a
Nap-neutrínók a Földet elérik, egy részük már átalakul müon- vagy
tau-neutrínóvá, az elektron-neutrínók észlelésére érzékeny kísérletek
pedig ezeket nem tudják detektálni.
A hipotézis igazolására a 90-es években újabb, más
alapelveken működő neutrínódetektorok épültek. Ezek egyike volt a
kanadai Sudbury Neutrino Observatory (SNO). 1984-ben Herb Chen vetette
fel, hogy a nehézvíz alkalmas lehet a probléma tisztázására, mivel a
nehézvízben – szemben a korábban alkalmazott anyagokkal – olyan
reakciók is végbemehetnek, amelyek különbséget tesznek a különböző
neutrínók között, lehetővé téve az oszcilláció közvetlen
megfigyelését. A kísérlet céljára még 1984-ben kiválasztották az egyik
legmélyebben fekvő bányát, a mintegy 2 km mélyen fekvő Creighton
Mine-t (Sudbury, Kanada). Ilyen mélyre semmilyen kozmikus részecske
nem tud már lehatolni, csak a neutrínók. A projekt 1990-ben kapta meg
a hivatalos zöld jelzést.
A detektor 6 m sugarú, gömb alakú, átlátszó
akriltartályában 1000 tonna (!) nehézvíz van (URL1). A tartály körüli
üreget könnyűvízzel töltötték meg, amelynek a felhajtóereje nagyrészt
tehermentesíti az akriltartály tartószerkezetét, valamint árnyékolja a
kőzet radioaktív anyagaiból esetleg jövő sugárzást.
A neutrínók érzékelése a gyenge kölcsönhatás segítségével történik. A
nehézvízzel – egyedülálló módon – mérni lehet az elektron-neutrínók
ne fluxusát
és energiaeloszlását, valamint az összes neutrínó
nx fluxusát.
A detektorban lezajló három reakció:
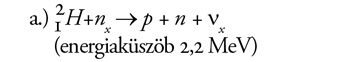
A deuteron szétbontása. Ezt mindhárom fajta neutrínó meg tudja tenni.
A standard napmodell szerint az SNO-detektorban naponta 30 neutronnak
kellene keletkeznie.
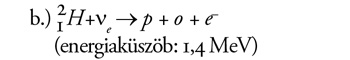
Mivel itt egy neutron protonná és elektronná alakul, ezt a reakciót
csak az elektron-neutrínó tudja létrehozni. Ez is a nehézvízre
jellemző reakció, amellyel mérhető az elektron-neutrínók fluxusa. A
standard napmodell szerint az SNO-detektorban naponta 30 ilyen
eseménynek kellene bekövetkeznie.
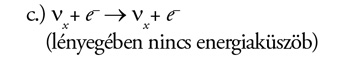
Ez tulajdonképpen rugalmas szóródás elektronon, amire mindhárom
neutrínó képes, bár az elektron-neutrínó kölcsönhatásának
valószínűsége kb. hatszor akkora, mint a másik két neutrínóé. A
standard napmodell szerint az SNO-detektorban naponta mindössze három
ilyen eseménynek kellene bekövetkeznie.
A detektor vizében a nagy sebességű elektronok
Cserenkov-sugárzást bocsátanak ki, a detektor körül gömbszimmetrikusan
elhelyezett tízezer fotoelektron-sokszorozó ezt a sugárzást észleli.
Az a.) reakcióban nem keletkezik nagy sebességű
elektron, ott a keletkezett neutronokat kell észlelni. A nehézvízben –
mivel jó moderátor – a neutronok lelassulnak, termalizálódnak. A
termikus neutronok észlelésére két módszert is alkalmaztak.
– 2001 júniusában kb. két tonna szupertiszta
konyhasót (NaCl) oldottak a nehézvízben. A termikus neutronok nagy
hatáskeresztmetszettel befogódtak a klóratommagokba, gammasugárzást
bocsátva ki. A nehézvízben terjedő gammasugarak elektronokat löktek
meg Compton-effektussal, a meglökött gyors elektronok
Cserenkov-sugárzását pedig a fotoelektron-sokszorozókkal már mérni
lehetett.
– 2003 szeptemberében kivonták a sót a nehézvízből,
és 2004 elején 11 m hosszú láncokban 3He töltésű proporcionális
kamrákat „lógattak be”, összesen mintegy 800 m hosszúságban. Ezek igen
jó hatásfokkal detektálják a termikus neutronokat. Ezzel a NaCl-os
méréseket más – közvetlenebb – neutrondetektálási módszerrel is
megerősítették.
A NaCl-os első mérés után, 2001-ben adták ki az
első tudományos közleményt arról, hogy sikerült igazolni a
Nap-neutrínóknál is a neutrínó-oszcillációt (a légköri eredetű
neutrínókra a japán Super-Kamiokande-detektor már valamivel korábban
kimutatta ezt − Ahmad et al., 2001).
Atomenergetika • A nehézvíz nagy mennyiségben
történő első felhasználója az atomenergetika volt. A maghasadás
felfedezése csak néhány hónappal előzte meg a II. világháború
kitörését. Ezért szinte azonnal nagy erőkkel indult meg az atomenergia
makroszkopikus felszabadításáért folyó verseny. Hamarosan
nyilvánvalóvá vált, hogy a rendelkezésre álló természetes urán nem
alkalmas atomfegyver előállítására, mivel robbanásszerű önfenntartó
láncreakcióra csak igen magas 235U koncentráció mellett van
esély. A két uránizotóp szétválasztása nem lehetetlen, de nagyon
nehéz, sok energiát és időt igénylő folyamat, hiszen kémiai módszerek
nem használhatók. Egy másik út, amely az atomreaktor megvalósításán
keresztül vezetett, akkor egyszerűbbnek tűnt. Az atomreaktorban lévő
neutronok egy része a 238U-ba befogódva azt – két béta
bomlás után – 239Pu-má alakítja. A plutónium kémiailag
könnyebben elválasztható az urántól, hiszen más a rendszáma, és
magfizikai szempontból majdnem ugyanolyan jó bombakészítésre, mint a
tiszta 235U. (Később viszont kiderült, hogy bár a tiszta plutónium
előállítása atomreaktorral valóban nem nagyon nehéz, de szerencsére
plutóniumból sokkal nehezebb bombát készíteni).
Az akkor rendelkezésre álló természetes urán
üzemanyaggal lényegében csak nehézvíz vagy szupertiszta grafit
moderátorral lehetett önfenntartó láncreakcióra képes atomreaktort
építeni. A németek – Walter Bothe kísérletei alapján – a grafitot nem
is találták alkalmasnak, ezért a hitleri Németország atomprogramját
kizárólag a nehézvízre alapozták.
A moderátor azáltal segíti a láncreakciót, hogy a
neutronokat termikus energiára lassítja le, a lassú neutronok pedig
sokkal nagyobb valószínűséggel – a sebességükkel fordított arányban
álló hatáskeresztmetszettel – hoznak létre maghasadást. Azt, hogy egy
anyag milyen „jó” moderátor, lényegében három paraméter szabja meg:
a.) A rugalmas neutronszórás hatáskeresztmetszete (Ses);
b.) Az átlagos logaritmikus energiaveszteség (ζ),
amely az egy ütközésben átlagosan átadott energiahányaddal arányos;
c.) A neutronelnyelés hatáskeresztmetszete (Sa).
Egy moderátoranyag annál jobb, minél nagyobb az
első két paraméter, és minél kisebb a harmadik. A moderátor „jóságát”
ezért legjobban a
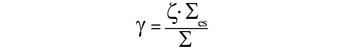
dimenzió nélküli szám fejezi ki. Az alábbi
összehasonlítás néhány moderátoranyagra mutatja ezeket az értékeket.
|
anyag |
g |
|
nehézvíz (D2O) |
7760 |
|
grafit (C) |
234 |
|
könnyűvíz (H2O) |
149 |
|
berillium (9Be) |
146 |
Látható, hogy a nehézvíz sokkal jobb moderátor bármely más anyagnál.
Nehézvíz moderátorral több kísérleti atomreaktor működött, és működik
jelenleg is a világon. Villamos energia termelésére szolgáló, nagy
teljesítményű, nehézvízzel és természetes urán üzemanyaggal üzemelő
atomreaktorokat Kanada fejlesztett ki. A típus neve: CANDU (CANada
Deuterium Uranium). Közelünkben Romániában (Cernavodă) üzemelnek ilyen
atomerőművi blokkok.
A nehézvízzel moderált rendszerek
plutónium-előállítás szempontjából is különösen kedvezőek. Az ún.
konverziós faktor, amely azt mutatja, hogy a reaktorban egységnyi
elhasznált hasadóanyaggal mennyi „új” hasadóanyagot (pl. plutóniumot)
lehet előállítani, a nehézvizes reaktoroknál sokkal magasabb, mint a
könnyűvízzel moderált reaktoroknál. Ezért – megfelelő
reaktorkonstrukció és üzemeltetési paraméterek mellett – a nehézvizes
reaktorokat jó hatásfokkal lehet plutóniumtermelésre is használni. A
nemzetközi közvélemény ezért kíséri megkülönböztetett figyelemmel és
aggodalommal a politikailag instabil régiókban és országokban
(Észak-Korea, Irán) épülő, illetve üzemelő, nehézvízzel működő
kísérleti vagy energiatermelő reaktorokat.
Fúzió • A nehézvíz kapcsán nem maradhat említés
nélkül a jövő egyik ígérete, a fúzió. A jelenlegi elképzelések szerint
a jövő fúziós erőműveiben a
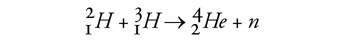
folyamat fogja termelni az energiát. A reakcióhoz szükséges tríciumot
(a hidrogén 3-as tömegszámú izotópja) lítiumból neutronokkal lehet
majd előállítani, de a deutériumot természetesen nehézvízből nyerik. A
nehézvíz tehát a maghasadáson alapuló energiatermelés mellett a fúziós
energiatermelésben is központi szerephez jut.
Kulcsszavak: nehézvíz, eredete, felfedezése, biológiai hatása,
alkalmazásai, deutérium kozmikus eredete, atomenergetika,
SNO-neutrínódetektor
IRODALOM
Ahmad, Q. Rushdy et al (2001): Measurement
of the Rate of νe+d→p+p+e- Interactions Produced by 8B Solar Neutrinos
at the Sudbury Neutrino Observatory. Physical Review Letters. 87,
071301 DOI: 10.1103/PhysRevLett.87.071301
Aston, Francis W. (1935): Masses of some
Light Atoms determined by a New Method. Nature 135, 3414, 541.
Birge, Raymond Thayer − Menzel, Donald H.
(1931): The Relative Abundance of the Oxygen Isotopes, and the Basis
of the Atomic Weight System. Physical Review. 37, 1669–1671.
DOI:10.1103/PhysRev.37. 1669.2
Epstein, Richard I. − Lattimer, J. M. −
Schramm, D. N. (1976): The Origin of Deuterium. Nature 263, No. 5574,
198–202. •
WEBCÍM >
Katz, Joseph J. (2008): Chemical and
Biological Studies with Deuterium. 39th Annual Priestly Lecture.
Pennsylvania State University, Univ. Park, PA. 1–110.
Kushner, D. J. − Baker, A. − Dunstall, T.
G. (1999): Pharmacological Uses and Perspectives of Heavy Water and
Deuterated Compounds. Canadian Journal of Physiology and Pharmacology.
77 (2): 79–88. DOI: 10.1139/y99-005
Lamb, Arthur Becket − Lee, Richard Edwin
(1913): The Densities of Certain Dilute Aqueous Solutions by a New and
Precise Method. Journal of the American Chemical Society. 35,
1666–1693. DOI: 10.1021/ja02200a003
Lewis, Gilbert N. (1933): The Isotope of
Hydrogen. Journal of the American Chemical Society. 55, 3, 1297–1298.
DOI: 10.1021/ja01330a511 •
WEBCÍM >
•
WEBCÍM >
Lewis, Gilbert N. − MacDonald, Ronald T.
(1933): Concentration of H2 Isotope. The Journal of Chemical Physics.
1, 341. doi:10.1063/1.1749300
Pittendrigh, Colin S. − Caldarola, P. C. −
Cosbey, E. S. (1973): A Differential Effect of Heavy Water on
Temperature-dependent and Temperature-Compensated Aspects of Circadian
System of Drosophila pseudoobscura. Proceedings of the National
Academy of Sciences of the USA. 70, 7, 2037–2041. •
WEBCÍM >
Richet, Pascal − Bottinga, Y. − Javoy, M.
(1977): A review of hydrogen, carbon, nitrogen oxygen, sulphur, and
chlorine stable isotope fractionation among gaseous molecules. Annual
Reviews Earth and Planetary Sciences. 5, 65–110. DOI:
10.1146/annurev.ea.05.050177.000433
Shchepinov, Mikhail S. (2007): Reactive
Oxygen Species, Isotope Effect, Essential Nutrients, and Enhanced
Longevity. Rejuvenation Research 10, 1, 47–60.
doi:10.1089/rej.2006.0506
Urey, Harold C. − Brickwedde, F. G. −
Murphy, G. M. (1932): A Hydrogen Isotope of Mass 2. Physical Review
39, 164–165. •
WEBCÍM >
Washburn, Edward W. − Urey, Harold C.
(1932): Concentration of the H2 Isotope of Hydrogen by the Fractional
Electrolysis of Water*. Proceedings of the National Academy of
Sciences of the USA. 18, 7, 490–496. •
WEBCÍM >
URL1
|