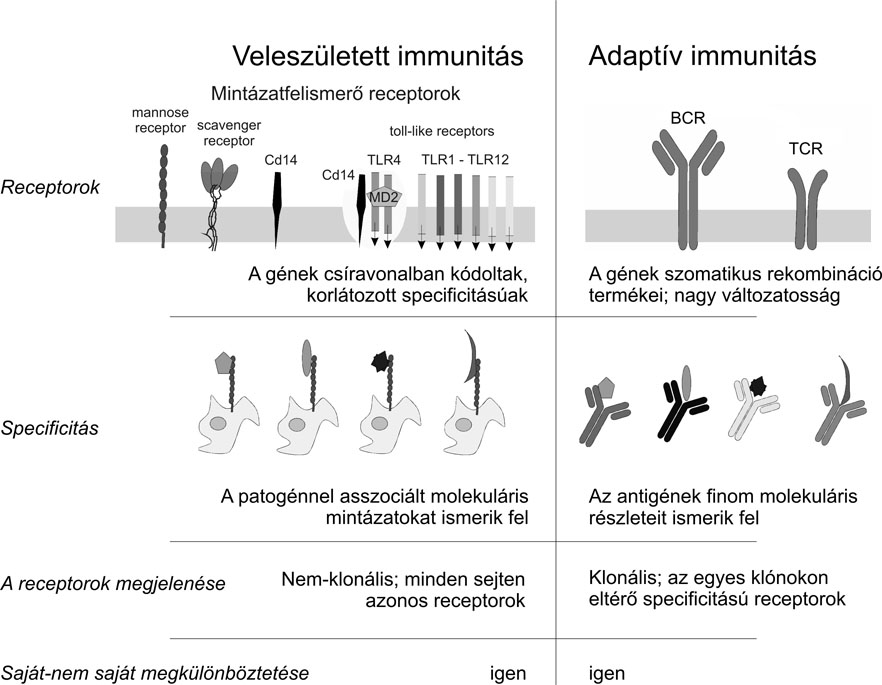
 1. ábra * A nyirokszervek megjelenése a gerincesek evolúciója során
1. ábra * A nyirokszervek megjelenése a gerincesek evolúciója során
A magasabb rendű állatfajokat, illetve az embert megtámadó patogén mikrobák szervezetbe jutásuk után a természetes immunrendszer elemeivel találkoznak először. Az ilyenkor azonnal működésbe lépő pusztító mechanizmusokban egyrészt különböző sejtek - köztük makrofágok, természetes ölősejtek és hízósejtek -, másrészt különböző oldékony faktorok - a komplementrendszer, citokinek, antibakteriális fehérjék - vesznek részt. E veleszületett funkciók gyors aktiválódása azt eredményezi, hogy a káros mikrobák - vírusok, baktériumok, gombák, különböző paraziták - jelentős része rövid időn belül elpusztul, így nem indulhat meg korlátlan elszaporodásuk. Ha ezek a mechanizmusok nem működnének, szervezetünk (illetve a magasabb rendű szervezetek) áldozatul esne a különböző fertőzéseknek. Emellett a nagyon fontos funkció mellett a természetes immunitás elemeinek döntő szerepük van az adaptív immunválasz megindításában, irányának meghatározásában is. Ezt a funkciót elsősorban a makrofágok és a nyúlványos, ún. dendritikus sejtek közvetítik, de a többi tényező (komplementrendszer, hízósejtek, természetes ölő-(NK)-sejtek stb.) szerepe sem elhanyagolható. A makrofágok és a dendritikus sejtek elsődleges szerepe a kórokozó felvételét követően az idegen struktúra finom részleteinek bemutatása az adaptív immunrendszer kulcsszereplői, a limfociták számára. Ez utóbbi sejtek aktiválódása vezet el a nagymértékű fajlagosságot és immunológiai memóriát is biztosító adaptív immunválasz kialakulásához (Janeway, 2002; Erdei, 2003; Andó et al., 2003; Rajnavölgyi, 2003).
A természetes és az adaptív immunrendszer legjellemzőbb vonásait az 1. táblázatban foglaltuk össze. Látható, hogy mindkét rendszernek van előnye és hátránya egyaránt. Fontos megjegyezni, hogy a nagyfokú fajlagosságot és immunológiai memóriát biztosító adaptív rendszer nem működhet a természetes immunrendszer elemei nélkül; a kettő egymásra épülve, összefonódva tartja fenn a magasabb rendűek immun-homeosztázisát.
A természetes vagy veleszületett immunrendszer kialakulása nyilvánvalóan összefügg azzal az evolúciós lépéssel, amikor létrejöttek a többsejtű, kolóniaképző állatok. Ekkor már szükség volt egyfajta "saját" felismerésre, ami lehetővé tette, hogy a különböző telepek integritása megmaradjon. Ez jól nyomon követhető például a szivacsok esetében; kísérletek bizonyítják, hogy míg az azonos kolóniába tartozó egyedek keringésének összekapcsolása nem okoz semmiféle változást, a különböző szivacstelepek összekötése az érintkező felületek közelében meginduló sejtpusztuláshoz vezet. Az immunrendszer fejlődésének következő meghatározó lépése volt, amikor a táplálkozás és a védekezés elkülönült egymástól, és az állatok szervezetében számos szabadon keringő sejtféleség jelent meg. E sejtek jelentős részét a legkülönfélébb anyagok bekebelezésére képes fagociták alkotják. Az alacsonyabb rendű állatfajok, illetve azok egyes sejtjeinek természetes védelmi mechanizmusait nagyon jól lehet tanulmányozni az atlanti tőrfarkúakban. Ezek a sokszor akár félméteres nagyságúra is megnövő tengeri állatok a pókok, skorpiók közé tartoznak. Érdekesség, hogy a fosszíliák bizonysága szerint ezek az állatok kétszázmillió évvel ezelőtt is ugyanilyen formában léteztek, mint ma, tehát védelmi rendszerük nagyon hatékonyan működik. Az atlanti tőrfarkú hemolimfájában találhatók az ún. granuláris hemociták, amelyek a természetes védelem fontos elemei. Ezek a sejtek endotoxin hatására azonnal aktiválódnak, és számos antibakteriális peptid termelésére képesek. Az ízeltlábúak másik nagyon fontos természetes védelmi mechanizmusa a kapszulaképzés és az ezt követő melanizáció, mellyel a behatoló kórokozót körülzárják, majd ártalmatlanná teszik.
Nagy változást jelentett az evolúció során az alacsonyabb rendű gerinces fajok megjelenése. Ezek az állatok általában nagyobb termetűek, élettartamuk hosszabb, és kevesebb utódot hoznak létre, mint a korábban kialakult fajok. Életben maradásuk és a faj fenntartása érdekében ezeknek az állatoknak már fejlettebb, hatékonyabb adaptív immunrendszerre volt szükségük. A porcos halaknál jelennek meg először az "igazi" limfociták, a limfoid szövetek és az IgM izotípusú ellenanyagok. Ezek az antitestek bár nem túl nagy affinitással, de sokféle anyaghoz képesek kötődni és így a kórokozók pusztulásához vezető folyamatokat elindítani.
Újabb fontos lépés volt a szárazföldi léthez való alkalmazkodás; a hüllők, madarak és emlősök megjelenése. Ezekben a fajokban a természetes immunrendszerre ráépülve tovább finomodott az adaptív immunrendszer. Újabb immunglobulin (Ig) izotípusok jöttek létre, elkülönültek a T-sejtek segítő és citotoxikus alpopulációi, és kialakultak a komplex limfoid szervek. Az immunrendszer működésének további finomra hangolását tette szükségessé az állandó testhőmérséklet kialakulása, mivel ez számos kórokozó túlélésének is kedvezett.
Végül pedig az immunrendszer működésének legmagasabb szintű és talán legfinomabb szabályozását az anya-magzat kapcsolat kialakulása tette szükségessé. Terhesség esetén ugyanis az anyában fejlődő magzat genetikai állománya fele részben az apától származik, tehát a folyamat úgy is tekinthető, mint egy jelentős részében idegen test "transzplantációja" az anyaméhbe. Jelentős részben az immunrendszer terhesség alatt működő szabályozó mechanizmusainak köszönhető, hogy - normál körülmények között - nem "lökődik ki" a magzat, ugyanakkor az is, hogy kilenc hónap elteltével megszülethet az utód (Szekeres-Barthó, 2003).
A gerincesek evolúcióját, illetve ennek során az egyes limfoid szövetek/szervek kialakulását az 1. ábrán mutatjuk be. Mintegy 550 millió évvel ezelőtt, a körszájúakban (például orsóhal) jelent meg a bélrendszerrel asszociált limfoid szövet (GALT). 420 millió éve a csontos halakban kialakultak az első kezdetleges nyirokszervek: a lép és a tímusz, majd a kétéltűekben a csontvelő. A madarak kialakulásával, mintegy 160 millió éve jelentek meg a csíraközpontok, majd az emlősökben a nyirokcsomók is kifejlődtek.
Az adaptív immunrendszer kialakulásában döntő fordulatot jelentett kb. 420 millió évvel ezelőtt az ún. RAG-enzimeket kódoló gének beépülése a korai gerincesek genomjába. Ezek az enzimek teszik lehetővé azokat a szomatikus génátrendeződési folyamatokat, amelyek eredményeként kialakulhat a T- és a B-limfociták antigénkötő receptorainak hatalmas, 109-1011-es méretű készlete. Az így kialakuló repertoár összemérhető a környezetben fellelhető idegen struktúrák nagyságrendjével. Sőt, tudjuk azt is, hogy immunrendszerünk kapacitása, illetve képlékenysége olyan mértékű, hogy még azokat a struktúrákat is képes felismerni, illetve a sajáttól megkülönböztetni, amelyek a természetes környezetben bizonyosan nem fordulnak elő - ilyenek például a mesterségesen előállított szintetikus molekulák. Korábban többféle elmélet született e sokféleség kialakulásának magyarázatára. Így például az ún. "csíravonal elmélet" képviselői azt gondolták, hogy a nagyszámú gén mind jelen van az egyes egyedek genomjában. Ma már tudjuk, hogy az embernek hozzávetőleg "mindössze" harmincezer génje van, könnyű tehát belátni, hogy a milliárdnyi variábilis fehérjeszekvenciát nem kódolhatják a csíravonal génjei, hiszen ehhez sokkal nagyobb méretű genomra lenne szükség. A sokféleség eredetének magyarázatát az immunglobulinokat (Ig) kódoló gének és fehérjetermékeik megismerése tette lehetővé.
Az idegen anyagok, antigének felismerésében kulcsszereplők az ellenanyag (antitest, Ig) molekulák. Ezek a két-két ún. nehéz és könnyű fehérjeláncból álló antitestek konstans doménekből és nagymértékű változékonyságot mutató variábilis doménekből épülnek fel (2. ábra, bekarikázott modell). Ez utóbbi szakaszok teszik lehetővé a sokféle idegen struktúra, az antigén felismerését. Az ellenanyag molekulák nagyfokú variabilitását (és hasonlóan ehhez, a T-sejtek antigénkötő receptorláncainak variabilitását) elsősorban a fehérjék egyes szakaszait kódoló gének nagy száma és szomatikus átrendeződése biztosítja. Az antigénfelismerő molekulák fehérjeláncainak variábilis részeit számos génszegmentum kódolja, amelyek a limfociták egyedfejlődése során véletlenszerűen rendeződnek át, vagyis rekombinálódnak. Emberben az Ig könnyűlánc esetén például több mint negyven, a nehéz láncok esetén több mint hatvanöt variábilis génszakasz található, melyek bármelyike kapcsolódhat a többi, ún. J-, illetve D-szegmentumokkal. A limfociták antigénkötő receptorainak hatalmas variabilitását tehát elsősorban a RAG-enzimek által katalizált szomatikus génátrendeződési folyamatok biztosítják. Fontos kiemelni, hogy ez a folyamat kizárólag a T- és a B-limfocitákban zajlik le, semmilyen más sejtféleségben nem. Ezt a mechanizmust - számos korábbi Nobel-díjas kutató eredményeire is támaszkodva - egy japán immunológus, Tonegava Szuszumu (Tonegava, 1988) írta le, aki szintén Nobel-díjban részesült ezért a felfedezésért.
A placentával rendelkező emlősökben az evolúció eredményeként öt ellenanyag-osztályt (Ig-izotípust) különíthetünk el. E molekulák azonban szintén hosszú, évmilliókon át zajló fejlődés eredményeként jöttek létre. Az Ig-gének evolúciója kezdetén, a porcos halakban csak IgM termelődött, majd a csontos halakban megjelent az IgD, ami "eltűnt" az evolúció során, és az emlősökben jelent meg újra. A tojással szaporodó hüllőkben és madarakban az ősi IgM mellett megjelenik az IgY izotípus, és a madarak esetében az IgA. Feltehetőleg az IgY-ból jött létre az emlősök IgE-je, és az ismét megjelenő IgD- vel így van jelen ez utóbbi fajokban mind az öt izotípus.
Figyelemre méltó, hogy milyen "evolúciós próbálkozások" eredményeként alakult ki az Ig molekulák szerkezete. Ez jól nyomon követhető a porcos halak antitestjeit vizsgálva: a mindig jelen lévő variábilis domének mellett az IgW-ben hat, az IgX-ben mindössze két konstans domén található (2. ábra). A dajkacápa Ig-je (NAR) pedig olyan könnyű láncot tartalmaz, amelynek nincs konstans doménje. E molekulák többsége a fejlődés zsákutcájának tekinthető, mivel az evolúció során nem őrződtek meg.
Az eddigiek során főként az adaptív immunrendszert alkotó limfociták nagy fajlagosságal rendelkező antigénfelismerő receptorairól esett szó. Azonban nyilvánvaló, hogy a szervezetbe jutó patogénekkel legelőször kapcsolatba kerülő sejtek, a veleszületett immunrendszerhez tartozó makrofágok és dendritikus sejtek is valamilyen módon fel kell hogy ismerjék a szervezet számára veszélyt jelentő idegen struktúrákat (Gergely, 2003). A kétféle szinten való felismerést biztosító receptorok jellemzőit a 3. ábrán foglaltuk össze. Lényeges különbség, hogy a makrofágok és a dendritikus sejtek a patogének jellemző mintázatait csíravonalban kódolt receptoraikkal ismerik fel (Kocsis - Emődy, 2003; Prechl, 2003), szemben a limfocitákkal, melyek antigénfelismerő receptorai szomatikusan átrendeződött gének termékei. Különbség az is, hogy az előbbiek a kórokozók jellemző molekuláris mintázatait (cukoroldalláncok, lipidmolekulák ismétlődő egységeit) ismerik fel, szemben a limfocitákkal, melyek az antigének finom molekuláris részleteivel reagálnak. Fontos továbbá, hogy a mintázatfelismerő receptorok (PRR - Pattern Recognition Receptors) megjelenése nem klonális, míg az egyes limfocitaklónokon eltérő specificitású receptorok jelennek meg.
Mindezek után felvázolható a magasabb rendűek szervezetébe kerülő kórokozó hatására kialakuló immunválasz folyamata (4. ábra). A patogén mikroba többnyire sérült felületen - bőrön, nyálkahártyán - át jut a szervezetbe. A természetes immunrendszer azonnal működő, pusztító mechanizmusai az esetek többségében az összes kórokozót képesek elpusztítani, többnyire észrevétlenül. Bizonyos esetekben azonban nem elég ez a védekezés, ilyenkor az adaptív immunrendszer aktiválódik. Ennek megindulásához azonban feltétlenül szükségesek a természetes immunrendszer elemei, köztük elsősorban a nyúlványos, dendritikus sejtek és a makrofágok. Ezek a sejtek a támadás helyszínén felvett kórokozót a legközelebbi nyirokcsomóba szállítják, ahol lehetőség van az adaptív immunrendszer kulcsszereplői, a limfociták aktiválására. Az ilyenkor lezajló immunfolyamatokat jelzi a megnagyobbodott, fájdalmas tapintású nyirokcsomó vagy mandula, láz és levertség érzete. Az immunreakciók eredménye a megfelelő fajlagosságú limfocitaklónok szelekciója és felszaporodása, majd ezt követően a megfelelő effektorsejtek és ellenanyag-molekulák termelése nagy mennyiségben. Ez utóbbiak a keringéssel a fertőzés helyére jutnak, ahol mintegy megjelölik a még jelen lévő kórokozót, amelyet így ismét a természetes immunrendszer - elsősorban a makrofágok és a komplementrendszer - elemei pusztítanak el. Így néhány nap elteltével visszaáll az egészséges állapot.
Összességében tehát elmondható, hogy az állatvilág evolúciója során kialakult magasabb rendű gerinces fajok hatékony, nagy fajlagosságot és immunológiai memóriát is biztosító védelmét a természetes és az adaptív elemek csak együttműködve képesek kialakítani; önmagában egyik immunrendszer sem elegendő.
Kulcsszavak: természetes immunrendszer, adaptív immunrendszer, evolúció, fagocitasejtek, limfociták, receptorok, nyirokszervek
Természetes Evolúciósan Azonnal Korlátozott Nincs Nem vihető át immunitás ősibb aktiválódik mértékű memória másik egyedbe fajlagosság Adaptív Gerincesekkel 1-2 hét alatt Korlátlan Memóriát Átvihető immunitás alakult ki alakul ki mértékű biztosít másik egyedbe fajlagosság
1. táblázat * A természetes és adaptív immunitás jellemzői
Evolúciós lépés, szelekciós nyomás Immunológiai történés Többsejtűek, kolóniaképző állatok kialakulása Allogén felismerés, "szövet-összeférhetőség" Mezoderma és keringési rendszer kialakulása, Sokféle, szabadon keringő vérsejt a táplálkozás és a védekezés elkülönülése (köztük fagociták) megjelenése, a sejtes immunitás első jelei Alacsonyabbrendű gerincesek megjelenése, "Igazi" limfociták, halak (nagyobb test, hosszabb élettartam, limfoid szövetek kialakulása, kevesebb utód) IgM-típusú ellenanyag megjelenése Szárazföldi lét, Újabb Ig-izotípusok, hüllők, madarak, emlősök kialakulása komplex limfoid szervek megjelenése Állandó testhőmérséklet kialakulása, A celluláris és a humorális immun- a kórokozóknak is kedvezőbb körülmények válasz összehangolása, az immun Élveszülés, anya-magzat kapcsolat rendszer működésének finomítása a magzat kilökésének elkerülésére.
2. táblázat * Az immunrendszer fejlődése az állatvilág fejlődése során
 1. ábra * A nyirokszervek megjelenése a gerincesek evolúciója során
1. ábra * A nyirokszervek megjelenése a gerincesek evolúciója során
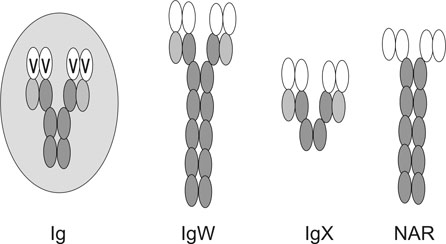 2. ábra *"Evolúciós próbálkozások" - a porcoshalakban található
ellenanyagmolekulák (IgW, IgX, NAR) szerkezete (bekarikázva a magasabbrendű
gerincesek immunglobulin molekulájának alapszerkezete)
2. ábra *"Evolúciós próbálkozások" - a porcoshalakban található
ellenanyagmolekulák (IgW, IgX, NAR) szerkezete (bekarikázva a magasabbrendű
gerincesek immunglobulin molekulájának alapszerkezete)
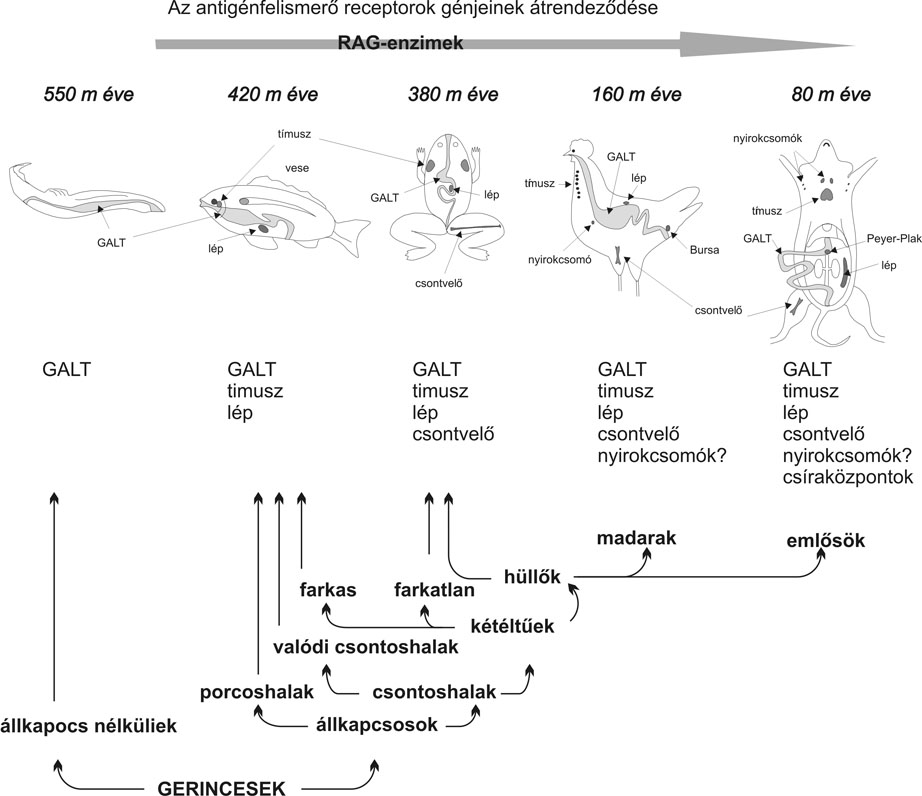 3. ábra * A veleszületett és az adaptív immunrendszer idegen struktúrákat
felismerő receptorainak jellemzői
3. ábra * A veleszületett és az adaptív immunrendszer idegen struktúrákat
felismerő receptorainak jellemzői
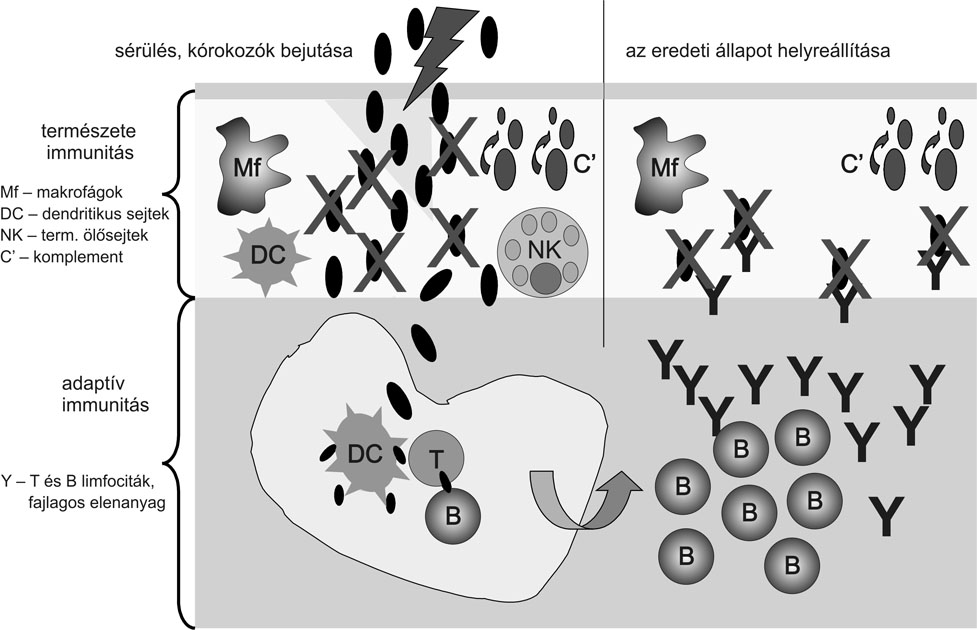 4. ábra * A kórokozó leküzdése a természetes és az adaptív immunrendszer
összefonódó működésének eredménye
4. ábra * A kórokozó leküzdése a természetes és az adaptív immunrendszer
összefonódó működésének eredménye
Szószedet
antigén: az immunrendszer elemei által felismert molekula
antimikrobiális peptidek: a veleszületett immunitás sejtes elemei által termelt, alacsony molekulatömegű széles hatásspektrumú peptidek, melyek a membrán károsításával pusztítják el a szervezetbe jutó mikrobákat (baktériumok, gombák, protozoák)
apoptotikus sejtek: programozott sejthalálban elpusztuló sejtek, méretük csökken, örökítő anyaguk szétesik
CD antigének: (Cluster of Differentiation): monoklonális ellenanyagokkal kimutatható, vérsejttípusra, vagy -altípusra jellemző molekulák
Drosophila: ecetmuslica (Drosophila melanogaster)
hemocita: a rovarok vérsejtje
ioncsatorna: olyan transzmembrán fehérjék, melyek a membránban csatornát képezve a membránon keresztül történő iontranszportot végzik
leukociták: a gerincesek fehérvérsejtei
lizozim: Gram+ baktériumok ellen ható antimikrobiális peptid, mely a sejtfal glikozidkötéseit bontja
melanizáció: a kristálysejtek által termelt profenoloxidáz aktiválását követő láncreakció végterméke, a melanin pigmentnek nagyméretű idegentestek köré történő lerakódása
monoklonális ellenanyag: egy adott ellenanyag-termelő sejtklón terméke
plazmatocita: a rovarok vérsejtjeinek egy alosztálya, mely a testidegen részecskék bekebelezését végzi valamint antimikrobiális peptidek termelésében vesz részt.
profenoloxidáz: a kristálysejtek specifikus enzimjének, a fenoloxidáznak proenzimje. A melanin pigment képződését eredményező proteolitikus láncreakciót katalizáló fehérjék egyike
proliferáció: a sejtek osztódásával létrejövő sejtszám-növekedés
proteolízis, proteolitikus kaszkád: egymást követő fehérjehasítási lépések sorozata, melynek során az inaktív fehérjék a hasítást követően aktív állapotba kerülnek
regulátor régió: a gének kódoló szakaszától különböző régió, mely a gének időbeni és térbeni kifejeződését (expresszióját) szabályozza. Ezekhez a régiókhoz kötődnek a transzkripciós faktorok
screen: mutációk, mutánsok izolálása nagyszámú egyed átvizsgálásával
TNF: (Tumor Necrosis Factor) a gerincesek aktivált makrofágjai által termelt citokin. Citotoxikus hatású, akut fázis válaszban és gyulladásos folyamatokban játszik szerepet
Toll receptor: a Toll receptorcsalád Drosophilában található tagja, ahol az embrionális élet során a hát-hasi polaritás kialakításáért, lárvában és kifejlett rovarban pedig az antimikrobiális peptidek termeléséért felelős jelátviteli utak egyik kulcsszereplője
transzkripciós faktorok: olyan fehérjék, melyek a gének szabályozó régióihoz kötődnek, és azok időbeni és térbeni kifejeződését szabályozzák
transzmembrán fehérje: olyan fehérjék, melyek a sejtmembránban helyezkednek el, azt átívelik, és mindkét felszínével érintkeznek
transzplantáció: szövet vagy sejtek átültetése egyik egyedből a másikba
Irodalom
Andó István - Laurinyecz B. - Nagy I. - Márkus R. - Rus, F. - Váczi B. - Zsámboki J. - Fehér L. - Gateff, E. - Hultmark, D. - Kurucz É. (2003): Ősi örökségünk: a veleszületett immunitás. Magyar Immunológia, 4.
du Pasquier, Louis (2001): The Immune System of Invertebrates and Vertebrates. Comparative Biochemistry and Physiology B: Biochemistry and Molecular Biology. 129. 1-15
Erdei Anna (2003): A természetes immunitás hatalma. Magyar Tudomány, 4.
Gergely János (2003): Az immunológiai felismerés - hol állunk ma és merre haladunk? Magyar Immunológia, 4.
Janeway, Charles A. Jr. - Medzhitov Ruslan (2002): Innate Immune Recognition. Annual Review of Immunology. 20, 197-216
Kocsis Béla, Emődy Levente (2003): A baktériumok patogénmintázata és a gazdaszervezeti felismerés. Magyar Immunológia, 4.
Prechl József (2003): A Toll-szerű receptorok szerepe a természetes immunitás kezdeti lépéseiben. Magyar Immunológia, 4.
Szekeres-Barthó Júlia (2003): Immunológiai párbeszéd az anya és a magzat között. Magyar Tudomány, 4.
Tonegawa, Susumu (1988): Nobel Lecture in Physiology or Medicine-1987. Somatic Generation of Immune Diversity. In Vitro Cellular and Developmental Biology. 4. 253-65. ( http://www.nobel.se/medicine/laureates/1987/tonegawa-lecture.pdf)