A szervezet immunológiai egyensúlyának fenntartása - vagyis a környezet patogén ingereire adott hatékony immunválasz, ugyanakkor a saját struktúrákkal szembeni válaszképtelenség (tolerancia) kialakítása - az antigént fajlagosan felismerő B és T limfociták aktív működésének eredményeként jön létre. A B sejtek az ellenanyagtermeléssel járó, ún. humorális immunválaszért, míg a T limfociták a sejtes immunválasz létrejöttéért felelősek. A B és a T sejtek funkciójukat egymással és a természetes immunválasz sejtjeivel szoros együttműködésben fejtik ki. Az antigén fajlagos felismerése, amely a két sejttípusnál eltérő mechanizmussal történik, mind a B, mind a T sejteknél receptorok közvetítésével megy végbe. Fejlődésük során a sejtek aktív tanulási folyamat eredményeként sajátítják el azt a képességüket, hogy a saját és nem saját struktúrákat megkülönböztessék. Ebben a folyamatban az antigénfelismerő receptorok közreműködésével a sejtekbe érkező jelek döntő szerepűek, meghatározzák a sejtek sorsát: a túlélést (pozitív szelekció) vagy a programozott sejtpusztulást (negatív szelekció).
Ismereteink a B sejtek antigén felismerő receptoraira vonatkozólag régebbiek, ami arra vezethető vissza, hogy a szérumból az ellenanyagok, más néven immunglobulinok (Ig) viszonylag könnyen tisztíthatók és vizsgálhatók. 1900-ban Paul Erlich receptor-elmélete vetette fel először, hogy a sejtek felszínén levő antigén receptorok és a keringésben kimutatható, az antigént fajlagosan felismerő ellenanyagok azonosak lehetnek. Ebben az időben még sem az egyes immunkompetens sejttípusok, sem az ellenanyag szerkezete nem volt ismert. A zseniális jóslatot a későbbi megfigyelések igazolták, és az módosításokkal ma is érvényes. Mai ismereteink szerint a B sejteken kifejeződő sejtfelszíni immunglobulinok (sIg) a B sejt receptor komplex (BCR) antigénfelismerésért felelős egységei, melyek a sejtmembránhoz való kapcsolódást biztosító néhány aminosav kivételével azonosak a plazmasejtté érett B sejtek által termelt ellenanyagokkal.
A B sejtek fejlődése a csontvelőben kezdődik, és alapvetően a sejtfelszíni immunglobulinok irányítása alatt áll (Meffre et al., 2000). A sIg kezdetben azáltal vezérlik a B sejtek fejlődését, hogy felismerik a sejtek környezetében levő saját struktúrákat, és ezzel irányítják a B sejtek negatív és pozitív szelekcióját. Érett stádiumban, a sejtfejlődés antigéntől függő szakaszában az sIg közvetítik a B sejtek aktiválódásához vezető jeleket, kiváltják a sejtmembrán fehérjéinek átrendeződését és az antigén internalizációját is, ezzel lehetővé teszik az antigén feldolgozását és az antigénből származó peptidek bemutatását a T sejtek számára, s ezzel hozzájárulnak a T sejtek aktiválásához.
A B sejtek az egész élet folyamán állandóan képződnek a csontvelőben, ahonnan érett formában a perifériás nyirokszervekbe, a lépbe és a nyirokcsomókba vándorolnak. A sejtfejlődés folytonossága ellenére a B sejtek száma a periférián állandó, mivel az antigénnel való találkozást követően plazmasejtté érnek, melyek nagy része elpusztul. Azok a B sejtek, amelyek bizonyos időn belül nem találkoznak antigénnel, szintén erre a sorsra jutnak. A B sejtek életben maradását a BCR által közvetített jelek biztosítják, amelyek kivédik a programozott sejthalálhoz vezető jeleket. Érett B sejtekben a BCR a sejtek aktiválódásához, a klonális osztódáshoz vezető jeleket közvetít, míg éretlen B sejtekben, érdekes módon, a BCR programozott sejtpusztulás (apoptózis) kiváltására is képes (Defrance et al. 2002).
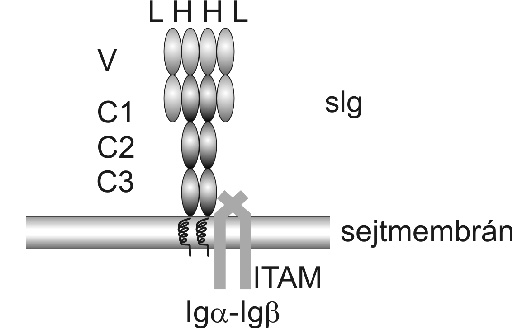
Hogyan továbbíthat a BCR a sejtek életét meghatározó jeleket? A sIg szerkezetének megismerése fényt derített arra, hogy a két nehéz- és két könnyűláncból álló, diszulfid hidakkal összekapcsolt molekula jeltovábbításra önmagában nem alkalmas, hiszen csupán négy aminosavból áll a sejten belüli szakasza. A jelátadásért a sIg transzmembrán doménjéhez nem kovalens kötéssel kapcsolódó két járulékos fehérjelánc, az Igalfa és Igbéta láncok felelősek, amelyek egymással diszulfid hidak segítségével heterodimert alkotva csatlakoznak az antigénfelismerő sIg alegységhez (1. ábra) (Schamel-Reth, 2000). A járulékos láncok sejten belüli doménjében az ún. immunoreceptor tirozin alapú aktivációs motívum (ITAM) található, melynek tirozinjai a sejtaktiváció kezdeti lépései során az Src családba tartozó tirozin kinázok aktiválódásának eredményeként foszforilálódnak. Ezt egy további tirozin kináznak (Syk) a jeltovábbító láncok foszfotirozin maradékaihoz való kapcsolódása és aktiválódása, valamint számos sejten belüli fehérje foszforilációja követi (DeFranco et al., 1995).

1. ábra. A B sejt receptor komplex szerkezete. L, könnyűláncok; H, nehézláncok; V, variábilis domének; C, konstans domének; Igalfa-Igbéta, jelátvivő járulékos láncok.
A B sejtek fejlődése két szakaszra osztható, a korai sejtfejlődés az antigéntől független, míg a későbbi lépéseket az antigén irányítja (2. ábra). Az antigéntől független B sejt fejlődés a csontvelőben zajlik, ahol a pro-B sejtek, majd a pre-B sejtek túlélését a csontvelői sztrómasejtekkel való szoros kapcsolat biztosítja. A BCR fehérjeláncai közül elsőként az Igalfa és Igbéta láncok jelennek meg a pro-B sejtek felszínén, ezek funkciója ebben a stádiumban nem tisztázott. Megjelenésük előfeltétele az elsőként átrendeződő Ig lánc, a mu nehézlánc sejtfelszíni kifejeződésének. A kezdetben csak a citoplazmában kimutatható mu lánc a pre-B sejtek felszínén már komplexet alkot az Igalfa és Igbéta láncokkal. Ez a pre-BCR könnyűláncot még nem, helyette pót-könnyűláncokat tartalmaz, amelyek kapcsolódnak a mu lánchoz (Burrows - Cooper, 1997). A B sejtek fejődésének első, a sIg által ellenőrzött pontja a működőképes mu lánc génátrendeződése és fehérje sejtfelszíni expressziója. Sokáig vitatott volt, hogy mi lehet a pre-BCR liganduma, milyen molekulákat ismerhet fel, amelyek a további sejtfejlődést biztosítják. Az utóbbi évek kutatómunkája során vált világossá, hogy maga a megfelelő leolvasási keretben történő Ig nehézlánc génátrendeződés és a funkcióképes fehérje sejtfelszíni megjelenése az előfeltétele a további fejlődésnek (Rolink et al., 2001). Ez tehát az első pozitív szelekciós lépés, mely a pro-B- pre-B sejt átmenetet irányítja, és jeleket továbbít a nagy pre-B sejtek intenzív osztódásához. Ennek hiányában, ha például hibás leolvasás eredményeként nem működőképes pre-BCR jön létre, a sejt programmozott sejthalállal (apoptózis) elpusztul. A helyes átrendeződés egyben gátolja a nehézlánc további átrendeződését (allél exklúzió), és így biztosítja a "jó" receptor megtartását is. A pre-BCR által továbbított jel tehát konstitutív, vagyis ligandum kötődését nem igényli (Rolink et al., 2000).
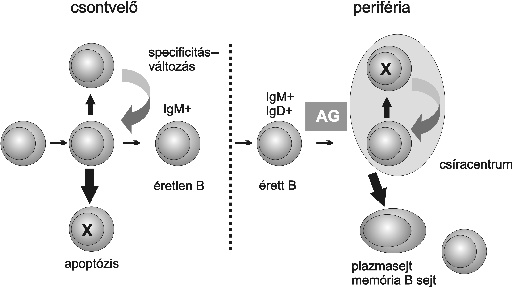
2. ábra. A B sejtek fejlődése
Saját munkánk során egér B sejtvonalakon végzett kísérleteinkkel kapcsolódtunk be a pre-BCR által közvetített jelátadás érdekes kérdésének vizsgálatába. Megállapítottuk, hogy a jelátadás egyik fontos, adapter molekulája, a B sejt "linker" fehérje (BLNK) a pre-B sejt vonal sejtjeiben konstitutívan tirozinon foszforilált állapotban van, és ezen a pre-BCR mu lánc specifikus ellenanyaggal való keresztkötése, amivel egy esetleges ligandum kötődését szerettük volna szimulálni, nem változtat lényegesen (Kövesdi et al., 2002). A foszforilált BLNK összekapcsolja a Syk tirozin kinázt a további jelátadásban fontos molekulákkal, mint például a Bruton-típusú protein kináz (Btk) és a foszfolipáz Cgamma (PLCgamma), amelyek kapcsolódnak a BLNK foszfotirozinjaihoz. Ez további fehérjefoszforilációs lépéseket tesz lehetővé.
A sejtmembrán szerveződésének vizsgálata során az utóbbi években írták le, hogy a sejtfelszíni receptorok éppúgy, mint a membrán belső felén a receptorokhoz csatlakozó, jelátadásban részt vevő molekulák nem úsznak szabadon a membrán lipid tengerében, hanem ún. koleszterinben gazdag membrán mikrodoménekben helyezkednek el. Ezek a membrán lipid tutajok (raftok) fontos szerepet töltenek be a jeltovábbításban, hiszen összegyűjtik a jelátadásban részt vevő enzimeket és azok szubsztrátjait, s ezzel felerősítik a jelet (Pierce, 2002). Megállapítottuk, hogy amíg az érett B sejtekben csak a ligandum kötődése, és a BCR átrendeződése váltja ki e fontos jeltovábbító fehérjék lipid tutajokba való áthelyeződését, a pre-B sejtekben a BLNK és a hozzá kapcsolódó PLCgamma konstitutívan a lipid tutajokban foglal helyet, s így ligandumkötés hiányában is állandó jeltovábbításra képes (Kövesdi et al., 2002). Újabb vizsgálatok igazolták elképzelésünk helyességét. Néhány hónapja írták le, hogy a B sejtek korai fejlődését irányító Pax5 transzkripciós faktor pre-B sejtekben aktiválja a BLNK gén expresszióját, amely a molekula foszforilációjához vezet. A Pax5 hiányában vagy a BLNK mutációja esetén nincs jelátadás, és a B sejtek fejlődése megreked a pro-B stádiumban (Schebesta et al., 2002). A BLNK tehát kulcsmolekulája a pre-BCR által közvetített konstitutív jelátadásnak. A pre-BCR sokrétű feladatot tölt be: biztosítja a pre-B sejtek túlélését, proliferációs szignálokat és végül a könnyűlánc génátrendeződéséhez vezető jeleket indukál. A pre-BCR közvetítette jelek váltják ki a rekombinációt aktiváló gének (Rag1 és Rag2) átmenti szuppresszióját is, amely az allél exklúzióért, tehát a további nehézlánc génátrendeződés letiltásáért felelős.
A pre-BCR megjelenése után a sejtek citokinigénye megváltozik. Korábban az IL-7-re és a sztrómasejtek által termelt más citokinekre volt szükségük a túléléshez, és a további fejlődéshez. A késői, kis pre-B sejtek már érzéketlenek ezekre a faktorokra, miután elveszítik a megfelelő receptoraikat. Megindulnak viszont olyan génátírási folyamatok, melyek más növekedési faktorok kötődését teszik lehetővé, ami végül az éretlen B sejtek kialakulásához vezet (Burrows - Cooper, 1997). Ezt a Rag gének expressziójának újabb hulláma előzi meg, és így megindulhat a könnyűlánc gének átrendeződése. E folyamat lezárulásával kifejlődnek az éretlen B sejtek, amelyek már az érett B sejtekre jellemző BCR-rel rendelkeznek. Ez a stádium nagyon fontos a B sejtek életében, hiszen receptoraik ekkor ismerhetnek fel először környezetükben levő saját molekulákat. A B sejtek ekkor sajátítják el a saját és nem saját struktúrák megkülönböztetésére szolgáló képességüket. Az éretlen B sejtek receptorai nagy mennyiségben jelen lévő saját struktúrával találkoznak. Azok a sejtek, amelyeknek a receptorai a saját molekulákat nagy affinitással ismerik fel programozott sejthalállal elpusztulnak, vagy pedig arra kényszerülnek, hogy új könnyűláncot hozzanak létre, s ezzel megváltoztassák a BCR specificitását. A könnyűláncok közül először a kappaláncot kódoló gén V és J szegmentuma - rendeződik át. Sikertelenség esetén, vagyis ha az így kialakult sIg saját struktúrára specifikus, ezt követheti még néhány újabb VJ rekombináció kipróbálása, majd a lambdalánc génátrendeződése következik. Miután a könnyű- és a nehézláncok hipervariábilis régiói együttesen biztosítják az antigén felismerését, az újabb könnyűlánc megjelenése a BCR specificitását megváltoztathatja. Ezt a jelenséget receptor átszerkesztésnek (receptor editing) nevezzük (Nemazee, 2000). Ha az új receptor már nem ismer fel további saját molekulát, az éretlen B sejt tovább fejlődik és átmeneti éretlen (tranzicionális T1 és T2) állapot után érett B sejtté alakul. Abban az esetben, ha a többszöri génátrendeződés sem sikeres, megvalósul az autoreaktív receptorral rendelkező B sejt apoptózisa. Az éretlen fejlődési stádiumban tehát a BCR által közvetített jel irányítja a sejtek további sorsát, ezúttal a negatív szelekciót.
Sokan próbáltak fényt deríteni arra a paradoxonra, hogy miképpen közvetíthet ugyanaz a BCR teljesen eltérő jeleket a B sejt érési stádiumától függően, nevezetesen, éretlen B sejtekben receptor-átszerkesztést, illetve apoptózist kiváltó, míg érett B sejtekben aktivációhoz és klonális osztódásához vezető jeleket. Számos eltérést találtak az érett és éretlen B sejtek jelátviteli folyamatai között, de pontos válasz még ma sem adható erre a kérdésre.
Az egyik lényeges eltérés az, hogy az érett sejtek receptorai a sejtmembrán lipid tutajaihoz kacsolódó jelátviteli komplexen (szignaloszóma) keresztül indítják el a sejten belüli aktivációs jeleket, míg az éretlen sejtekben a jelátvitel a lipid raftoktól függetlenül történik (Pierce, 2002). Bár a kérdés még vitatott, saját vizsgálataink során arra a következtetésre jutottunk, hogy ez feltehetően a BCR által közvetített jel időtartamát befolyásolja. A lipid tutajokhoz kapcsolódó jel hosszan megtartott, míg az ettől független jel csak átmeneti jellegű lehet. Ezt a kérdést szubletálisan besugárzott egereken vizsgáltuk, amelyek a besugárzást követő tizennégy nap eltelte után immunrendszerüket helyreállítják, és lépük ekkor nagyrészt éretlen, tranzícionális B sejteket tartalmaz (Koncz et al. 2002). A tranzícionális B sejtek apoptózisra rendkívül érzékenyek, a BCR keresztkötése IgM-specifikus ellenanyaggal - ami a nagy affinitású saját struktúra felismerését modellezi -, elindítja a programozott sejthalált. A korai jelátadási lépéseket vizsgálva megállapítottuk, hogy a BCR által indukált tirozin foszforilációs mintázat, valamint a sejten belüli calciumválasz nem mutat lényeges eltérést érett és éretlen sejteken. Ezzel szemben különbséget találtunk az extracelluláris szignálok által regulált kinázok (Erk) foszforilációjának kinetikájában. Érett B sejteken ezek a jelek több óráig fennálltak, míg éretlen B sejteken rövid idő (30-60 perc) elteltével lecsengtek (Koncz et al., 2002; Sármay et al., 2002). Az Erk 1,2 aktiválódásának előfeltétele treoninon és tirozinon történő foszforilációja, amelynek következtében a p-Erk a sejtmagba jut, és ott a korai aktivációs gének átírását kiváltó faktorokat (transzkripciós faktorokat) foszforilálja szerinen. Az Erk-ről leírták, hogy hosszú ideig megtartott foszforilációja szükséges a c-fos transzkripciós faktor foszforilálásához, stabilizálásához és aktiválásához. Az, hogy az Erk foszforilációját átmenetinek találtuk az éretlen B sejtekben, arra enged következtetni, hogy aktivációs génátírásra ebben az esetben nincs lehetőség, amelynek hiányában feltételezésünk szerint a sejt elpusztul.
De vajon mi indítja el a B sejt programozott elpusztulásához vezető jelet? Ennek vizsgálatára összehasonlítottuk az érett és éretlen B sejtekben a BCR közvetítésével kiváltható apoptózishoz vezető utakat. Az éretlen B sejtek apoptózisát nem a tumor nekrózis faktor receptor családba tartozó molekulák (halál-receptorok) ún. halál-doménjei indukálják a citoplazmában, hanem a BCR közvetített túlélő jel hiányában a mitokondriumtól függő apoptotikus útvonal indul el (nem közölt eredmény). Ennek az a lényege, hogy a mitokondrium membrán depolarizációja következtében citokróm C szabadul fel, amely egy további faktorhoz kötődve aktiválja az apoptózisban kulcsszerepet játszó proteázok, a kaszpázok egyikét, és ez a továbbiakban a sejtmagba jutva a DNS degradációját, s így a sejt elpusztulását idézi elő. Más vizsgálatok arra utalnak, hogy bizonyos protein kináz C (PKC) izoenzimek aktivációjában lehet különbség az érett és éretlen sejtek között, ami az utóbbiak esetében apoptózishoz vezet. Az apoptózishoz vezető, mitokondriumtól függő útvonalat érett B sejtekben a bcl-2 géncsalád tagjai, illetve a túlélést elősegítő jelátviteli folyamatok bizonyos fehérjék foszforilációján keresztül (anti-apoptotikus jelek) gátolhatják. Legújabban leírták a B sejt aktiváló faktort (BAFF), amely a tumor nekrózis faktor család tagja, és receptorát (BAFF-R), amely tranzícionális éretlen B sejtek számára közvetít túlélést biztosító jeleket (Mackay - Browning, 2002). E jel hiányában a B sejtek további fejlődése érett B sejtté nem lehetséges.
Érett B sejtekben a receptorok három csoportja szabályozza a sejtek életben maradását: az első a BCR, amely érett B sejtekben az aktivációs gének átírásához vezető jelpályákat aktiválja, a második a halál-receptor (Fas/CD95), mely a B sejtek szükségtelen aktiválódását akadályozza meg a T sejtektől független antigénekre adott válasz során. Ugyancsak ez a molekula lehet felelős a kis affinitású, esetleg autoreaktív B sejt klónok elpusztításáért, amelyek a szomatikus mutáció eredményeképpen keletkeznek a csíracentrumban. Így a fenti mechanizmus lehet felelős a keletkező ellenanyag affinitásának növekedéséért, az affinitás érésért. Végül a harmadik receptorcsalád a BAFF-R, amely kizárólag perifériás B sejtekre hat, ezeken belül a tranzicionálisan éretlen, illetve a marginális zónába tartozó B sejtek éréséhez vezető jeleket közvetíti (Defrance et al., 2002).
Az B sejtek a tranzicionális stádiumot elhagyva érett B sejtekké alakulnak. Az érett B sejtek a T sejtekkel együttműködve adnak immunválaszt bizonyos, T sejtektől függő antigénekre (Lindhout et al., 1997). Ennek során a B sejt, amely a sIg-en keresztül felismerte az antigént, osztódásba kezd, és kialakítja a csíracentrumokat. Itt megy végbe a szomatikus mutáció és az affinitás érés. Az antigéntől függő B sejt fejlődésre az a jellemző, hogy a sejt különböző jelek közvetítésével "menekül" a programozott sejthalál elől. Legelőször a T sejtek számára a dendritikus sejtek, valamint a B sejtek bemutatják az antigénből eredő peptideket. A B és a T sejtek ugyanannak az antigénnek eltérő epitópjait ismerik fel. A sIg felismeri az antigént, amelyet a B sejt feldolgoz, és bemutat a T sejtek számára. A sIg tehát nemcsak aktiválási jeleket közvetít, hanem az antigén internalizálásáért is felelős. A T sejt aktiválódik, és maga is aktiválási jeleket küld a B sejt számára. Ez a B sejteken jelenlevő CD40 és a T sejtek membránján megjelenő CD40 ligandum kölcsönhatásának eredményeként megy végbe. A csíracentrum kialakulása után a következő ellenőrzési pont a B sejtek életben tartására a follikuláris dendritikus sejtekkel (FDC) való kölcsönhatás során valósul meg. A sejtek között több ponton kapcsolat alakul ki. Az FDC az Fc receptorán megkötött antigénnel a BCR-en keresztül, az adhéziós molekulái segítségével, valamint a sejtmembránok közvetlen kapcsolódása révén apoptózist gátló jeleket közvetít a B sejtekbe. Ekkor történik a szomatikus mutáció, amikor a gyorsan osztódó B sejtek receptorának variábilis doménjében bekövetkező mutációk eredményeként a változó affinitással rendelkező B sejtek jönnek létre. Csak azok a sejtek maradnak életben, amelyek receptora az antigént nagy affinitással köti, mert csak ebben az esetben jöhet létre a BCR által közvetített erős anti-apoptotikus szignál. A kis affinitású, esetleg autoreaktivitást mutató sejtek apoptózissal elpusztulnak, bár lehetőség van az autoreaktív receptorok esetében a receptor revíziójára, vagyis újabb könnyűlánc gén V - J rekombinációra is. E folyamatok végeredményeképpen az életben maradó, nagy affinitású receptorral rendelkező B sejtek kerülnek a következő ellenőrzési pontra, amikor az FDC-vel és az antigén specifikus T sejtekkel egyaránt kölcsönhatásba lépve a B sejtek további anti-apoptotikus, és aktiválódáshoz, osztódáshoz vezető jeleket kapnak. Közben a T sejtek aktiválódása is végbemegy. A B sejteken az apoptózist kiváltó molekulák kifejeződése csökken, a CD40 és a BCR által közvetített jelek pedig erősödnek. A CD40-en keresztül érkező jelek hatására elindul az izotípusváltás is, vagyis a B sejtek más izotípusú (IgM helyett IgG) ellenanyagot kezdenek termelni. Az osztódó B sejtekből néhány osztódási ciklus után kialakulnak az ellenanyag-termelő plazmasejtek, illetve egy részükből a memóriasejtek.
Ez utóbbi lépésekhez a segítő T sejtekből érkező citokinekre is szükség van.
A B sejtek aktiválódásához vezető jelátviteli folyamatokat nemcsak a BCR, hanem ún. ko-receptorok is befolyásolják. A IIb típusú Fc receptorok negatív, míg a kettes típusú komplement receptor, illetve annak jelátvivő egysége, a CD19 pozitív szabályozó hatású. Ezeknek a ko-receptoroknak fontos szerepük van nemcsak az érett, hanem az éretlen B sejtek jelátviteli folyamatainak szabályozásában is (Buhl - Cambier, 1997).
Az érett B sejtekben a BCR-en keresztül történő stimuláció során tirozin foszforilációval kezdődő komplex biokémiai folyamatok indulnak el, amelyek végül a korai gének expressziójához és az apoptózis gátlásához vezetnek. A járulékos Igalfa/Igbéta láncokon levő ITAM a scr családba tartozó kinázok aktiválódásának eredményeként tirozinon foszforilálódik. A foszforilálódott ITAM-ok egy további kinázt a Syk-et kötik. Az ITAM-hoz kötődött Syk molekulák egymást keresztbe foszforilálják, aktiválják, majd számos szubszrátot foszforilálnak, köztük a BLNK-t és a Gab adapter-fehérjéket is. Ezután a foszforilált BLNK-hoz kapcsolódó Btk és PLCgamma aktiválódik. A PLCgamma membrán foszfolipidek hidrolízisén keresztül az intracelluláris Ca2+ szint emelésével járul hozzá a Ca-tól függő enzimek aktiválásához. A harmadik sejtaktivációs útvonal a foszfatidil inozitol 3-kináz (PI3-K) aktiválódásával kezdődik. A PI3-K által foszforilált foszfoinozitidek szerepe bizonyos jeltovábbító molekulák, például a Gab1 adapterfehérje membránhoz rögzítése. A foszforilált Gab számos további jelátadó fehérjét toboroz a BCR közelébe, felerősítve ezzel a BCR közvetítésével elindított jelet. A jelek összegződése végül a korai aktivációs gének átírásán keresztül a sejt válaszához vezet (DeFranco et al., 1995; Gold et al., 2000).
Az utóbbi idők során derült fény arra, hogy a B sejtek hibás működése következtében az autoreaktivitással rendelkező sejtek maradhatnak életben. Ezek aktiválódva patológiás autoreaktív klónokat hozhatnak létre, ami végül autoimmun betegségek kialakulásához vezethet (Zouali, 2002). Éppen ezért lényeges a B sejtek ontogenezise során lejátszódó események pontos és részletes felderítése, mert ezzel lehetőségünk nyílik a patológiás folyamatokba való beavatkozásra.
Kulcsszavak: apoptózis, B sejt, ellenanyag, ontogenezis, sejtaktiválódás
Irodalom
Buhl, Anne Mette - Cambier, John C. (1997): Co-receptor and Accessory Regulation of B-cell Antigen Receptor Signal Transduction. Immunological Reviews. 160, 127-38.
Burrows, Peter D. - Cooper, Max D. (1997): B Cell Development and Differentiation. Current Opinion in Immunology. 9, 2, 239-244.
Defrance, Thierry - Casamayor-Palleja, M. - Krammer, P. H. (2002): The Life and Death of a B Cell. Advances in Cancer Research. 86, 195-225.
DeFranco, Anthony L. - Richards, J. D. - Blum, J. H. - Stevens, T.L . - Law, D. A. - Chan, V. W. - Datta, S. K. - Foy, S. P. - Hourihane, S. L. - Gold, M. R. - et al. (1995): Signal Transduction by the B-cell Antigen Receptor. Annals of the New York Academy of Sciences. 766, 195-201.
Gold, Michael R. - Ingham, R. J. - McLeod, S. J. - Christian, S. L. - Scheid, M. P. - Duronio, V. - Santos, L. - Matsuuchi, L. (2000): Targets of B-cell Antigen Receptor Signaling: the Phosphatidylinositol 3-kinase/Akt/glycogen Synthase Kinase-3 Signaling Pathway and the Rap1 GTPase. Immunological Reviews. 176, 1, 47-68.
Koncz Gábor - Bodor Cs. - Kövesdi D. - Gáti R. - Sármay G. (2002): BCR Mediated Signal Transduction in Immature and Mature B Cells. Immunology Letters. 82, 1-2, 41-49.
Kövesdi, Dorottya - Koncz, G. - Iványi-Nagy, R. - Caspi, Y. - Ishiai, M. Kurosaki, T., Gergely, J. - Haimovich, J. - Sármay, G. (2002): Developmental Differences in B Cell Receptor-induced Signal Transduction. Cellular Signalling. 14, 6, 563-572.
Lindhout, Ernst - Koopman, G. - Pals, S. T. - de Groot, C. (1997): Triple Check for Antigen Specificity of B Cells During Germinal Centre Reactions. Immunology Today. 18, 12, 573-576.
Mackay, Fabienne - Browning, Jeffrey L. (2002): BAFF: A Fundamental Survival Factor for B Cells. Nature Reviews. Immunology. 2, 7, 465-75.
Meffre Eric - Casellas R. - Nussenzweig M. C. (2000): Antibody Regulation of B Cell Development. Nature. Immunology. 1, 5, 379-385.
Nemazee David (1999): Receptor Editing in B Cells. Advances in Immunology. 74, 89-126.
Pierce, Susan K. (2002): Lipid Rafts and B-cell Activation. Nature Reviews. Immunology. 2, 2, 96-105.
Rolink, Antonius G. - Schaniel C. - Andersson J. - Melchers F. (2001): Selection Events Operating at Various Stages in B Cell Development. Current Opinion in Immunology. 13, 2, 202-207.
Rolink, Antonius G. - Winkler T. - Melchers F. - Andersson J. (2000): Precursor B Cell Receptor-Dependent B Cell Proliferation and Differentiation Does Not Require the Bone Marrow or Fetal Liver Environment. The Journal of Experimental Medicine. 191, 1, 23-32.
Sármay Gabriella - Koncz G. - Bodor, C. - Kövesdi D. - Gáti R. - Gergely J. (2002): Signaling pathways leading to apoptosis or survival in immature and mature B cells. Annals of the New York Academy of Sciences. 973, 181-185.
Schamel, WolfgangW. - Reth, Michael (2000): Monomeric and Oligomeric Complexes of the B Cell Antigen Receptor. Immunity. 13, 1, 5-14.
Schebesta Michael - Pfeffer P. L. - Busslinger M. (2002) Control of Pre-BCR Signaling by Pax5-dependent Activation of the BLNK Gene. Immunity. 17, 4, 473-485.
Zouali, Moncef (2002): B Cell Diversity and Longevity in Systemic Autoimmunity. Molecular Immunology. 38, 12-13, 895-901.